
 ,W的最高正价为+7.
,W的最高正价为+7. 分析 前四周期元素X、Y、Z、W核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道电子数目为5,外围电子排布为3d54s2,故W为Mn元素,而X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素,据此解答.
解答 解:前四周期元素X、Y、Z、W核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道电子数目为5,外围电子排布为3d54s2,故W为Mn元素,而X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素.
(1)由上述分析可知,Z为Cl元素,在元素周期表中的位置:第三周期第ⅦA族,
故答案为:三;ⅦA;
(2)Y与X形成共价化合物为PH3,P原子形成3个P-H键,含有1对孤对电子,故P原子杂化方式为sp3,分子空间构型为三角锥形,
故答案为:sp3;三角锥形;
(3)Z为Cl元素,最高价氧化物对应水化物为HClO4,故答案为:HClO4;
(4)故W为Mn元素,外围电子排布为3d54s2,价电子排布图为 ,最高正价为+7,
,最高正价为+7,
故答案为: ;+7.
;+7.
点评 本题考查结构性质位置关系应用,推断元素是解题的关键,注意熟练掌握核外电子排布规律,会进行杂化方式与空间构型判断.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | v正(HI)=v逆(I2) | |
| B. | c(HI)=c(H2)=c(I2) | |
| C. | c(H2)、c(I2)、c(HI)保持不变 | |
| D. | 拆开2mol H-I共价键,同时生成1mol H-H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少进气量,增大进风量 | B. | 减少进气量,减少进风量 | ||
| C. | 不作任何改变 | D. | 增大进气量,减少进风量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
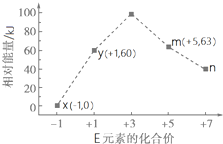 下表给出五种短周期元素的相关信息.
下表给出五种短周期元素的相关信息.| 元素 | 相关信息 |
| A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱:X>Y>Z | B. | 原子序数大小:X<Y<Z | ||
| C. | 原子半径大小:X<Y<Z | D. | 原子最外层电子数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 除去甲烷中少量的乙炔:通入酸性高锰酸钾溶液,再通入氢氧化钠溶液洗气 | |
| B. | 除去乙烯中少量的乙烷:通入足量溴水中,然后洗气 | |
| C. | 除去乙烷中少量的乙烯:光照条件下通入氯气,然后气液分离 | |
| D. | 除去苯酚中少量的苯:加入足量的氢氧化钠溶液,分液后在通入足量二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com