æ¼µć£ŗĪŽ»śĪļµÄĶʶĻ,¹¤ŅµÖĘČ”ĻõĖį,»ÆŃ§Ę½ŗā³£ŹżµÄŗ¬Ņå,»ÆŃ§Ę½ŗāדĢ¬µÄÅŠ¶Ļ
×ØĢā£ŗ»ÆŃ§Ę½ŗā×ØĢā,ŌŖĖŲ¼°Ęä»ÆŗĻĪļ
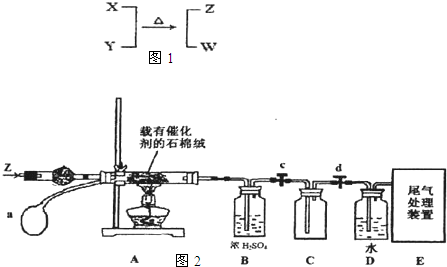
·ÖĪö£ŗX”¢Y”¢Z”¢W¾łĪŖ10µē×ӵķÖ×Ó»ņĄė×Ó£¬Ķس£×“æöĻĀ£¬WĪŖĪŽÉ«ŅŗĢåÅŠ¶ĻĪŖH
2O£¬XÓŠ5øöŌ×ÓŗĖ£¬·¢Éś·“Ó¦X+Y
Z+W£¬Ó¦ŹĒNH
4++OH
-=NH
3ӟ+H
2O£¬ĶʶĻXĪŖNH
4+”¢YĪŖOH
-”¢ZĪŖNH
3£¬
£Ø1£©·“Ó¦ĪŖN
2+3H
2?2NH
3£¬¼ĘĖćÉś³É2mol°±Ęų·Å³öµÄČČĮ棬עĆ÷ĪļÖŹµÄ¾Ū¼ÆדĢ¬ÓėģŹ±ä£¬ŹéŠ“ČČ»Æѧ·½³ĢŹ½£»
£Ø2£©¢Łøł¾Ż·“Ó¦ČČÅŠ¶ĻĪĀ¶ČĘ½ŗāµÄÓ°Ļģ£¬½ų¶ųÅŠ¶ĻĘ½ŗā³£Źż“󊔣»
¢Śµ±·“Ó¦“ļµ½Ę½ŗāדĢ¬Ź±£¬ÕżÄę·“Ó¦ĖŁĀŹĻąµČ£¬ø÷ĪļÖŹµÄÅØ¶Č”¢°Ł·Öŗ¬Įæ²»±ä£¬ŅŌ¼°ÓÉ“ĖŃÜÉśµÄŅ»Š©ĮæŅ²²»·¢Éś±ä»Æ£¬×¢ŅāŃ”ŌńµÄĪļĄķĮæÓ¦Ėę·“Ó¦·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»±ä»Æ£¬ĖµĆ÷µ½“ļĘ½ŗā£»
£Ø3£©¢ŁAÖŠ·¢Éś°±µÄ“ß»ÆŃõ»Æ£¬°±ĘųÓėŃõĘų·“Ӧɜ³ÉNOÓėĖ®£»
¢ŚĪüŹÕĖ®ÓėĪ“·“Ó¦µÄ°±Ęų£»
£Ø4£©DÖŠĪŖ¶žŃõ»ÆµŖÓėĖ®·“Ӧɜ³ÉĻõĖįÓėNO£»
£Ø5£©Õūøö¹ż³ĢÖŠ£¬°±Ęų±»Ńõ»ÆNO”¢NO±»Ńõ»ÆĪŖ¶žŃõ»ÆµŖ£¬¶¼ŠčŅŖŃõĘų£®
½ā“š£ŗ
½ā£ŗX”¢Y”¢Z”¢W¾łĪŖ10µē×ӵķÖ×Ó»ņĄė×Ó£¬Ķس£×“æöĻĀ£¬WĪŖĪŽÉ«ŅŗĢåÅŠ¶ĻĪŖH
2O£¬XÓŠ5øöŌ×ÓŗĖ£¬·¢Éś·“Ó¦X+Y
Z+W£¬Ó¦ŹĒNH
4++OH
-=NH
3ӟ+H
2O£¬ĶʶĻXĪŖNH
4+”¢YĪŖOH
-”¢ZĪŖNH
3£¬
£Ø1£©·“Ó¦ĪŖN
2+3H
2?2NH
3£¬Éś³É2mol°±Ęų·Å³öµÄČČĮæ=46.2kJ”Į2=92.4kJ£¬¹ŹøĆ·“Ó¦ČČ»Æѧ·½³ĢŹ½ĪŖ£ŗN
2£Øg£©+3H
2?2NH
3£Øg£©”÷H=-92.4KJ/mol£¬
¹Ź“š°øĪŖ£ŗN
2£Øg£©+3H
2?2NH
3£Øg£©”÷H=-92.4KJ/mol£»
£Ø2£©¢ŁÕż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżøßĪĀ¶ČĘ½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬Ę½ŗā³£Źż¼õŠ”£¬¹ŹK
1£¾K
2£¬
¹Ź“š°øĪŖ£ŗ£¾£»
¢ŚA£®Ę½ŗāŹ±ČŻĘ÷ÄŚø÷ĪļÖŹµÄÅضČÖ®±Č²»Ņ»¶Ø“óÓŚ»Æѧ¼ĘĮæŹż±Č£¬ÓėĪļÖŹµÄĘšŹ¼ÅØ¶Č”¢×Ŗ»ÆĀŹÓŠ¹Ų£¬¹ŹA“ķĪó£»
B£®ČŻĘ÷ČŻ»ż²»±ä£¬»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬Ćܶȏ¼ÖÕ±£³Ö²»±ä£¬ĆÜ¶Č²»±ä²»ÄÜĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹB“ķĪó£»
C£®Ėę·“Ó¦½ųŠŠ£¬·“Ó¦»ģŗĻĪļµÄĪļÖŹµÄĮæ¼õŠ”£¬ŗćĪĀŗćČŻ£¬Ń¹Ēæ½µµĶ£¬ČŻĘ÷ÄŚŃ¹Ēæ±£³Ö²»±ä£¬ĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹCÕżČ·£»
D£®»ģŗĻĘųĢå×ÜÖŹĮæ²»±ä£¬Ėę·“Ó¦½ųŠŠ£¬·“Ó¦»ģŗĻĪļµÄĪļÖŹµÄĮæ¼õŠ”£¬»ģŗĻĘųĢåĻą¶Ō·Ö×ÓÖŹĮæŌö“ó£¬Ę½¾łĻą¶Ō·Ö×ÓÖŹĮæ±£³Ö²»±ä£¬ĖµĆ÷µ½“ļĘ½ŗā£¬¹ŹDÕżČ·£¬
¹Ź“š°øĪŖ£ŗCD£»
£Ø3£©¢ŁAÖŠ·¢Éś°±µÄ“ß»ÆŃõ»Æ£¬°±ĘųÓėŃõĘų·“Ӧɜ³ÉNOÓėĖ®£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ4NH
3+5O
24NO+6H
2O£¬
¹Ź“š°øĪŖ£ŗ4NH
3+5O
24NO+6H
2O£»
¢ŚÅØĮņĖį×÷ÓĆŹĒĪüŹÕĖ®ÓėĪ“·“Ó¦µÄ°±Ęų£¬
¹Ź“š°øĪŖ£ŗĪüŹÕĖ®ÓėĪ“·“Ó¦µÄ°±Ęų£»
£Ø4£©DÖŠĪŖ¶žŃõ»ÆµŖÓėĖ®·“Ӧɜ³ÉĻõĖįÓėNO£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ3 NO
2+H
2O=2HNO
3+NO£¬
¹Ź“š°øĪŖ£ŗ3 NO
2+H
2O=2HNO
3+NO£»
£Ø5£©Õūøö¹ż³ĢÖŠ£¬°±Ęų±»Ńõ»ÆNO”¢NO±»Ńõ»ÆĪŖ¶žŃõ»ÆµŖ£¬¶¼ŠčŅŖŃõĘų£¬aÖŠĶØČėæÕĘų£¬Ńõ»Æ°±ĘųŗĶNO£¬
¹Ź“š°øĪŖ£ŗŃõ»Æ°±ĘųŗĶNO£®
µćĘĄ£ŗ±¾Ģāæ¼²éĪŽ»śĪļĶʶĻ”¢ČČ»Æѧ·½³ĢŹ½”¢»ÆŃ§Ę½ŗā³£Źż”¢Ę½ŗāדĢ¬”¢ĻõĖįµÄÖʱøµČ£¬ĢāÄæ±Č½Ļ×ŪŗĻ£¬ĶʶĻĪļÖŹŹĒ½āĢā¹Ų¼ü£¬×¢ŅāŹ¶¼Ē³£¼ū10µē×Ó”¢18µē×ÓĪ¢Į££¬ÄѶČÖŠµČ£®




 ÓĆČēĶ¼ĖłŹ¾×°ÖĆÖĘČ”“æ¾»µÄFe£ØOH£©2£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
ÓĆČēĶ¼ĖłŹ¾×°ÖĆÖĘČ”“æ¾»µÄFe£ØOH£©2£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£© ŌŚÉś²śÉś»īÖŠ£¬Ėį¼īÖŠŗĶ¼°ČÜŅŗĖį¼īŠŌŃŠ¾æ¾ßÓŠŹ®·ÖÖŲŅŖµÄŅāŅ壮
ŌŚÉś²śÉś»īÖŠ£¬Ėį¼īÖŠŗĶ¼°ČÜŅŗĖį¼īŠŌŃŠ¾æ¾ßÓŠŹ®·ÖÖŲŅŖµÄŅāŅ壮 A”¢B”¢C”¢D”¢E”¢FĮłÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®AµÄ×īøßÕż¼ŪŗĶ×īµĶøŗ¼ŪµÄ¾ų¶ŌÖµĻąµČ£®BµÄ»łĢ¬Ō×ÓÓŠ3øö²»Ķ¬µÄÄܼ¶ĒŅø÷Äܼ¶ÖŠµē×ÓŹżĻąµČ£®DµÄ»łĢ¬Ō×ÓÓėBµÄ»łĢ¬Ō×ÓµÄĪ“³É¶Ōµē×ÓŹżÄæĻąĶ¬£¬EµÄ»łĢ¬Ō×ÓµÄsÄܼ¶µÄµē×Ó×ÜŹżÓėpÄܼ¶µÄµē×ÓŹżĻąµČ£¬FµÄ»łĢ¬Ō×ÓµÄ3d¹ģµĄµē×ÓŹżŹĒ4sµē×ÓŹżµÄ4±¶£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
A”¢B”¢C”¢D”¢E”¢FĮłÖÖŌŖĖŲµÄŌ×ÓŠņŹżŅĄ“ĪŌö“ó£®AµÄ×īøßÕż¼ŪŗĶ×īµĶøŗ¼ŪµÄ¾ų¶ŌÖµĻąµČ£®BµÄ»łĢ¬Ō×ÓÓŠ3øö²»Ķ¬µÄÄܼ¶ĒŅø÷Äܼ¶ÖŠµē×ÓŹżĻąµČ£®DµÄ»łĢ¬Ō×ÓÓėBµÄ»łĢ¬Ō×ÓµÄĪ“³É¶Ōµē×ÓŹżÄæĻąĶ¬£¬EµÄ»łĢ¬Ō×ÓµÄsÄܼ¶µÄµē×Ó×ÜŹżÓėpÄܼ¶µÄµē×ÓŹżĻąµČ£¬FµÄ»łĢ¬Ō×ÓµÄ3d¹ģµĄµē×ÓŹżŹĒ4sµē×ÓŹżµÄ4±¶£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ