
A、O2-的结构示意图: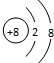 |
B、Na2S的电子式: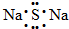 |
| C、甲醛的结构简式:CH2O |
D、氮分子的结构式: |
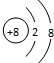 ,故A正确;
,故A正确;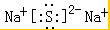 ,故B错误;
,故B错误;

 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
A、CH2=CH2+HBr
| |||
B、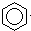 +Br2 +Br2
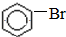 +HBr +HBr | |||
C、2CH3CH2OH+O2
| |||
D、CH4+2Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,SO2的浓度与SO3的浓度相等 |
| B、相同状况下,反应2SO3(g)?2SO2(g)+O2(g)是一个吸热反应 |
| C、为了提高SO2转化率,可适当提高O2浓度 |
| D、升高温度,放热反应的速率增大,吸热反应的速率也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
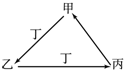 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为N2,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
| 3 | 63 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com