
【题目】五水硫酸铜(CuSO4·5H2O)和六水硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]都是重要的化工原料,用途十分广泛。
请回答与这两种物质中元素有关的一些问题。
(1)基态铁原子的核外电子排布式为_______;基态铜原子的电子占据的最高能层符号为_______ 。
(2)氧元素的第一电离能小于氮元素,其原因是_______ 。
(3)SO42-、H2O、NH4+三种微粒中,空间构型为正四面体的是_______;NH4+中氮原子的杂化轨道类型是_______。
(4)写出与SO42-互为等电子体的分子的化学式_______ (写一种)。
(5)Cu与Au的合金可形成面心立方最密堆积的晶体,在该晶胞中Cu原子处于面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______,若该晶体的密度为ρg.cm-3,则晶胞中Cu原子与Au原子中心的最短距离d=_______cm(NA表示阿伏加德罗常数的值)。

【答案】 1s22s22p63s23p63d64s2 N 氮原子的2p轨道处于较稳定的半充满状态,不容易失去一个电子,故第一电离能比氧元素大 SO42-、NH4+ sp3杂化 SiCl4或CCl4(其他合理答案也可) H4Cu3Au 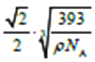
【解析】(1)铁的核电荷数为26,其基态铁原子的核外电子排布式为1s22s22p63s23p63d64s2;铜核电荷数为29,基态铜原子电子排布为1s22s22p63s23p63d104s1或[Ar]3d104s1,其最高能层为N;正确答案:1s22s22p63s23p63d84s2;N。
(2)氧元素的第一电离能小于氮元素,氮原子的2p轨道处于较稳定的半充满状态,不容易失去一个电子,故第一电离能比氧元素大;正确答案:氮原子的2p轨道处于较稳定的半充满状态,不容易失去一个电子,故第一电离能比氧元素大。
(3) ![]() 离子中含有4个
离子中含有4个![]() 键,没有孤电子对,所以其立体构型是正四面体,硫原子采取
键,没有孤电子对,所以其立体构型是正四面体,硫原子采取![]() 杂化;
杂化;![]() 分子中O原子的价层电子对数
分子中O原子的价层电子对数![]() ,为
,为![]() 杂化,含有2个孤电子对,分子为V形;
杂化,含有2个孤电子对,分子为V形;![]() 中N原子的价层电子对数
中N原子的价层电子对数![]() ,为
,为![]() 杂化,不含有孤电子对,为正四面体形;正确答案: SO42-、NH4+ ; sp3杂化。
杂化,不含有孤电子对,为正四面体形;正确答案: SO42-、NH4+ ; sp3杂化。
(4) 原子数、电子总数均相等的物质,称为等电子体;与SO42-互为等电子体的分子的化学式为SiCl4或CCl4;正确答案:SiCl4或CCl4。
(5)![]() 与
与![]() 的合金可形成面心立方最密堆积的晶体,在晶胞中
的合金可形成面心立方最密堆积的晶体,在晶胞中![]() 原子处于面心,该晶体具有储氢功能,氢原子可进入到由
原子处于面心,该晶体具有储氢功能,氢原子可进入到由![]() 原子与
原子与![]() 原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,金刚石晶胞结构为
原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,金刚石晶胞结构为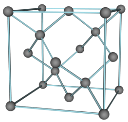 ,形成的晶体中,
,形成的晶体中,![]() 原子有4个,
原子有4个,![]() 原子数目为
原子数目为![]() ,
,![]() 的原子数目为
的原子数目为![]() ,该晶体储氢后的化学式为
,该晶体储氢后的化学式为![]() ;该晶体的分子质量为393,若该晶体的密度为ρg·cm3,则晶胞的体积为:
;该晶体的分子质量为393,若该晶体的密度为ρg·cm3,则晶胞的体积为:![]() ÷ρ=
÷ρ=![]() cm3 晶胞的棱长为r=
cm3 晶胞的棱长为r=![]() ,从结构中看出,晶胞中Cu原子与Au原子中心的最短距离d为面对角线的一般,即
,从结构中看出,晶胞中Cu原子与Au原子中心的最短距离d为面对角线的一般,即![]() r=
r=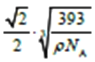 cm;正确答案:H4Cu3Au;
cm;正确答案:H4Cu3Au;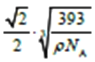 。
。


科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]﹣ , 铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法. 【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(1)写出Cr2O72﹣与FeSO4溶液在酸性条件下反应的离子方程式 .
(2)还原+6价铬还可选用以下的试剂(填序号).
A.明矾
B.铁屑
C.生石灰
D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4 , 再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:(填序号); A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
(4)【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去. 写出阴极的电极反应式 .
(5)电解法中加入氯化钠的作用是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在101kPa、25℃时,1.0g乙烷气体完全燃烧生成液态水时,放出热量52.0kJ,则乙烷燃烧的热化学方程式为( )
A.C2H6(g)+ ![]() O2(g)═2CO2(g)+3H2O(l)△H=﹣1560kJmol﹣1
O2(g)═2CO2(g)+3H2O(l)△H=﹣1560kJmol﹣1
B.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=﹣1560kJmol﹣1
C.C2H6(g)+ ![]() O2(g)═2CO2(g)+3H2O(l)△H=﹣52.0kJmol﹣1
O2(g)═2CO2(g)+3H2O(l)△H=﹣52.0kJmol﹣1
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A和B反应生成C,假定反应刚开始只有A、B,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则在这2 min内反应的平均速率VA =_______ mol/(L· min),VB =________ mol/(L· min),该反应2 min内A、B、C三种物质的化学反应速率之比为:________________________。
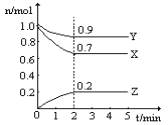
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如上图所示。根据图中数据,试填写下列空白:
①该反应的化学方程式为__________________________________________________;
②从开始至2min,Z的平均反应速率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日前正在研发的两种由电化学制取氨的装置如图1和图2所示:

下列说法正确的是
A. 工作时,O2-向X极移动,H+向Z极移动
B. 两个电解池的电解总反应方程式完全相同
C. 两个电解池生成相同量NH3时,电路中流过电子的物质的量相同
D. 随着反应的进行,两种电解池中电解质不断减少,需及时补充电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图. ①环境中的Cl﹣扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为;
②若生成4.29g Cu2(OH)3Cl,则理论上耗氧气体积为L(标准状况).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4x B. 4x+6 C. 4x+10 D. 4x+14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com