
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,
同素异形体是同种元素形成的不同单质,
具有相同分子式而结构不同的化合物互为同分异构体,
结构相似组成个相差CH2原子团的有机物互称为同系物.
解答 解:(1)①H与D,⑦16O和18O,是具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素,
故答案为:①⑦;
(2)②O2与O3,⑤C60与金刚石是同种元素形成的不同的氧元素的单质,为同素异形体,故答案为:②⑤;
(3)⑥尿素[(NH2)2CO]和氰酸铵(NH4CNO),⑧[Fe(S-C≡N)Cl2 和[Fe(N=C=S)Cl2,分子式相同结构不同的化合物为同分异构体,故答案为:⑥⑧;
(4)③乙醇(C2H5OH)与甲醇(CH3OH) ④正丁烷与丙烷 结构相似,组成相差CH2原子团的有机物互称为同系物,故答案为:③④.
点评 本题考查同位素、同分异构体、同素异形体、同系物的定义,题目难度不大,注意对概念实质的理解.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入NaOH溶液中:CO2+2OH-═CO32-+H2O | |
| B. | 铜与足量浓硝酸反应:Cu+4H++2NO3-═Cu2++2NO↑+2H2O | |
| C. | 碳酸钠固体溶于水:CO32-+2H2O?H2CO3+2OH- | |
| D. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素最高价氧化物的水化物肯定是一种强酸 | |
| B. | 该元素单质肯定是一种黄绿色的气体 | |
| C. | 该元素的最高价氧化物肯定能与强碱反应 | |
| D. | 该元素的原子半径在同周期中肯定是最小的(稀有气体元素除外) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
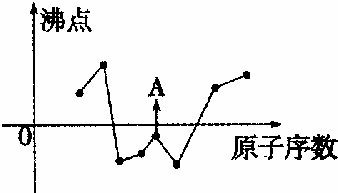
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
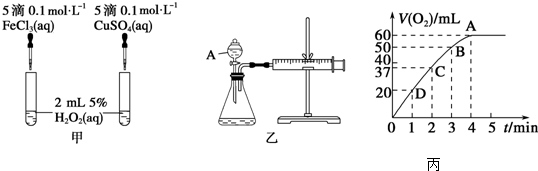
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
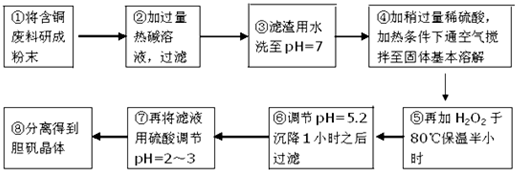
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl晶体中每个钠离子与周围6个氯离子形成6个离子键 | |
| B. | 前四周期元素的原子中,未成对电子数最多的是Mn | |
| C. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| D. | 岩浆冷却过程中,晶格能高的矿物晶体先结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速度 vA=2mol/(L•min)逆反应速度vB=2 mol/(L•min) | |
| B. | 正反应速度 vA=2mol/(L•min)逆反应速度vC=2 mol/(L•min) | |
| C. | 正反应速度 vA=1mol/(L•min)逆反应速度vB=1.5 mol/(L•min) | |
| D. | 正反应速度 vA=1mol/(L•min)逆反应速度vC=1.5mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com