
在通常情况下,A是固体单质。根据下图的转化关系,回答有关问题:
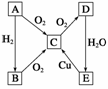
(1)写出下列分子式:
A:__________、C:__________、E:________。
(2)写出指定反应的化学方程式:
①B→C:________________________________________________________________________。
②C→D:________________________________________________________________________。
③E→C:________________________________________________________________________。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
I.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解
B.在250mL容量瓶中定容成250mL烧碱溶液
C.用碱式滴定管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞
D.将物质的量浓度为M mol/L的标准盐酸装入酸式滴定管,调整液面,记下开始刻度为V1 mL。
E.锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
回答下列问题:
(1)滴定达到终点的现象是 ;
(2)若酸式滴定管没有用标准盐酸润洗,会对测定结果有何影响 (填“偏高”“偏低”或“无影响”,其它操作均正确)
(3)该烧碱样品的纯度计算式是 。
II.(4)任何一个自发的氧化还原反应都可以设计成一个原电池。请根据:Fe+2Fe3+=3Fe2+,设计成一个原电池。该电池的正极材料为_____,其电极反应为__________________;电池中的电解质溶液可以选择 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中迅速制备少量氯气可利用如下反应:
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
此反应在常温下就可以迅速进行,而且对盐酸浓度要求不高。
(1)已知高锰酸钾和氯化锰都属于可溶性盐,请把上述化学方程式改写为离子方程式:________________________________________________________________________。
(2)该反应中,氧化剂是________,还原剂是________。当有1 mol氧化剂参加反应时,被氧化的还原剂的物质的量是________,产生的氯气在标准状况下的体积约为________。
(3)HCl在此反应过程中表现出的化学性质有________。
A.酸性 B.还原性
C.氧化性 D.挥发性
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应8NH3+3Cl2===6NH4Cl+N2,回答下列问题:
(1)氧化剂是________,还原剂是________。
(2)氧化剂与还原剂的分子个数比为_______________________________________。
(3)当有68 g NH3参加反应时,被氧化的物质为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中的臭氧层可使人类和其他生物免受紫外线的危害,人为因素可能使臭氧层受到破坏,下列因素可破坏臭氧层的是( )
A.SO2的排放
B.制冷剂氟氯烃(商品名氟利昂)的泄漏
C.CO2的排放
D.燃料的不完全燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
将某种铁的化合物溶于盐酸,滴加KSCN溶液不变色,再加入适量氯水,溶液立即变红色,该化合物是下列物质中的( )
A.Fe2O3 B.FeCl3
C.FeSO4 D.Fe(NO3)3
查看答案和解析>>
科目:高中化学 来源: 题型:
在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO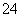 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
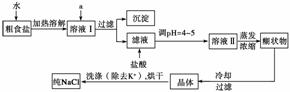
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO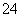 离子,选出a所代表的试剂,按滴加顺序依次为______________________(只填化学式)。
离子,选出a所代表的试剂,按滴加顺序依次为______________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,先用的试剂为__________。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外,还有__________(填仪器名称)。
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4===ZnSO4+H2↑
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
据此,从下列所给仪器中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号)。
可选用制备气体的装置:
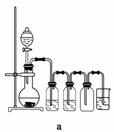

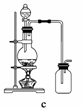
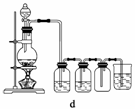
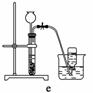
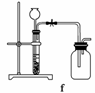
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在放电过程中的总反应方程式是:NiOOH + MH === Ni(OH)2 + M,下列说法错误的是
A.放电过程中负极的电极反应式:MH + OH--e-=== H2O + M
B.放电过程中OH-从正极向负极迁移
C.放电时若有1 mol M生成,则转移的电子数目为NA (NA为阿伏伽德罗常数的值)
D.NiMH电池中不能用KOH溶液作为电解质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com