
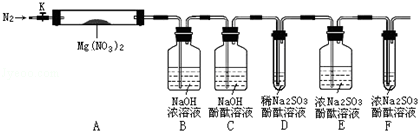
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.分析 本题主要是探究硝酸镁分解产物的成分,重点是设计实验证明有氧气生成,因NO2也有氧化性对氧气的检验有干扰应选择NaOH溶液吸收除去并通过滴有酚酞的NaOH溶液检验有无完全除尽,利用Na2SO3溶液的碱性及还原性来检验氧气的存在,原理是氧气能氧化亚硫酸钠溶液生成中性的硫酸钠,另外考虑到空气中有氧气,故要排除空气中氧气的干扰,据此分析解答;
①根据氧化还原反应中化合价有升高,一定也要降低角度进行判断;
②氮气分子中含有氮氮三键,最外层满足8电子稳定结构;各装置中都有氧气,避免空气中氧气干扰实验;
③根据二氧化氮为红棕色气体分析;
④二氧化氮影响氧气的检验,所以检验氧气前先必须证明二氧化氮已经除尽;
⑤若C中红色溶液中有气泡冒出,D中溶液褪色,则证明产物中有氧气;分别写出亚硫酸钠水解、亚硫酸钠被氧气氧化的方程式;
⑥根据质量守恒进行判断;
⑦根据以上分析可知,硝酸镁分解生成氧化镁、二氧化氮和氧气,据此写出反应的方程式;
⑧空气中有氧气,能够将亚硫酸钠氧化成硫酸钠导致溶液质量增加
解答 解:①Mg(NO3)2受热分解生成的氮化物中,N元素的化合价降低,则一定有化合价升高的元素,根据硝酸镁的组成可知,只能为-2价的氧元素失去电子生成氧气,
故答案为:N元素化合价降低,则一定存在化合价升高的元素,只能为氧元素失去电子生成O2;
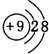
②氮气分子中含有氮氮三键,氮原子最外层达到8电子稳定结构,其电子式为: ;
;
步骤Ⅱ中,通入一段时间N2,目的是用氮气排出装置中空气避免对产物氧气检验的干扰,
故答案为: ;避免对分解产物O2的检验产生干扰;
;避免对分解产物O2的检验产生干扰;
③步骤Ⅲ中,装置A内若出现了红棕色气体,则该红棕色气体为NO2,故答案为:NO2;
④装置D用于检验氧气,而二氧化氮能够氧化亚硫酸钠,影响了氧气的测定,所以必须用装置C验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验,
故答案为:验证NO2是否被吸收干净,防止NO2干扰后续对O2的检验;
⑤若装置C中红色溶液中有气泡冒出,且试管D中亚硫酸钠的酚酞溶液褪色,则证明反应产物中有氧气,涉及的反应有:亚硫酸钠水解溶液呈碱性,所以滴有酚酞的溶液显示红色:Na2SO3+H2O?NaHSO3+NaOH、亚硫酸钠被氧化生成硫酸钠:2Na2SO3+O2=2Na2SO4,导致溶液褪色,
故答案为:C中红色溶液中有气泡冒出,D中溶液褪色;Na2SO3+H2O?NaHSO3+NaOH、2Na2SO3+O2=2Na2SO4;
⑥称取3.7gMg(NO3)2固体,反应后剩余1g固体,B中增重2.3g为二氧化氮质量,D、E增重的为氧气,质量为0.4g,总质量恰好为3.7g,说明反应产物中不会有氮气生成,
故答案为:Mg(NO3)2的质量与剩余固体、NO2、O2的质量之和相等,已符合质量守恒定律;
⑦取少量剩余固体于试管中,加入适量水,未出现明显现象,说明反应产物中没有氮化镁和亚硝酸镁,只能为氧化镁,结合其它分析可知,硝酸镁分解生成氧化镁、二氧化氮气体和氧气,反应方程式为:2Mg(NO3)2$\frac{\underline{\;加热\;}}{\;}$2MgO+4NO2↑+O2↑,
故答案为:2Mg(NO3)2$\frac{\underline{\;加热\;}}{\;}$2MgO+4NO2↑+O2↑;
⑧装置F的作用是吸收空气中氧气,避免干扰实验测定,由于亚硫酸钠与空气中氧气反应生成硫酸钠,导致试管F中溶液质量增加,
故答案为:吸收空气进入的O2所致.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验原理及化学实验基本操作方法为解答关键,注意掌握物质的性质及检验方法,试题侧重考查学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
 .
.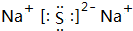 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 | |
| D. | 在一定条件下,某可逆反应正向是吸热反应,则其逆向必是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
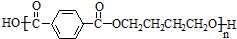
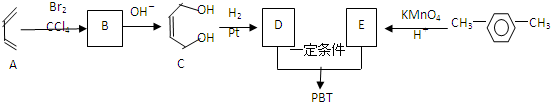
 互为同系物关系.
互为同系物关系.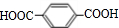 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$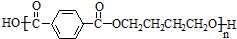 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的△H>0 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式CO+H2O(g)$?_{高温}^{催化剂}$CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
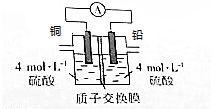 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.35 mol/L | B. | 8.70 mol/L | C. | 10.05 mol/L | D. | 11.40 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com