
 将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.
将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.| 1.06g |
| 1.66g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

 .T的核磁共振氢谱只有两组峰,则Q的结构简式为
.T的核磁共振氢谱只有两组峰,则Q的结构简式为 和
和 ,M的结构简式为
,M的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
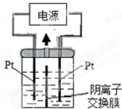
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ①443-573K |
| 熔烧 |
| ②进一步加热 |
| 到773-873K |
| 通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | A(g) | B(g) | C(g) |
| 物质的量/mol | 1.2 | 0.6 | 0.6 |
| A、反应前20 s内的平均反应速率为v(A)=0.6 mol?L-1?s-1 |
| B、20 s时,正反应速率大于逆反应速率 |
| C、达到平衡时,A(g)的转化率为100% |
| D、若升高温度平衡常数变为2,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(盐酸)<n(稀硝酸)<n(烧碱) |
| B、n(烧碱)<n(盐酸)<n(稀硝酸) |
| C、n(烧碱)<n(稀硝酸)<n(盐酸) |
| D、n(稀硝酸)<n(烧碱)<n(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )
Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示,若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )| A、Y单质与氢气反应较Z剧烈 |
| B、最高价氧化物对应水化物酸性W比Z强 |
| C、X单质氧化性强于Y单质 |
| D、X与W的原子核外电子数相差9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com