
【题目】钠通常保存在_________中,加热时,钠可以在空气中_________,发出________火焰,生成____________色固体。化学方程式为________________________。
科目:高中化学 来源: 题型:
【题目】工业上可以用天青石生产碳酸锶后的含锶废渣制备高纯六水氯化锶(SrCl26H2O),含锶废渣主要成分为SrCO3,且含钡、铁、钙等元素。六水氯化锶是一种无色长针状晶体,易溶于水,微溶于无水乙醇和丙酮,下面为实验室模拟SrCl26H2O的制作流程:
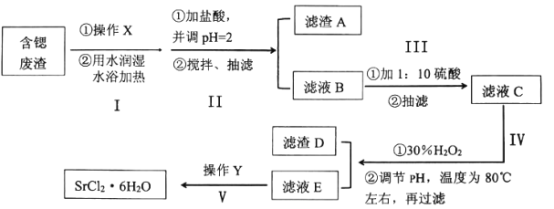
已知:①SrSO4微溶于水;
②SrCl26H2O在61.5℃以上即会失去4个结晶水生成SrCl22H2O。
(1)关于上述实验操作下列说法不正确的是___。
A.步骤I中操作X为研磨粉碎,可以增大反应接触面积
B.步骤III为提高产率,可以用滤液淋洗布氏漏斗中的滤渣
C.抽滤时,如果溶液有强酸性,可以用玻璃纤维代替滤纸
D.减压过滤不宜过滤胶状沉淀,因为胶状沉淀会在滤纸上形成一层密实的沉淀
E.步骤IV中的温度控制在80℃左右,可以用水浴加热,也可以用油浴或砂浴加热代替,更安全
(2)下表为实验中硫酸加入量对溶液中Ba2+和Sr2+含量的影响,实验发现在步骤III中加入硫酸量过量20%较合适,请解释原因:___。
硫酸加入量/mL | 4.50 | 4.95 | 5.40 | 5.85 | 6.30 |
Ba2+/(g/L) | 0.37 | 0.21 | 0.13 | 0.11 | 0.10 |
Sr2+/(g/L) | 90.21 | 89.86 | 89.57 | 89.23 | 88.90 |
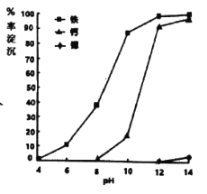
(3)①步骤IV调节pH时,为避免引入新的杂质,最适宜加入的试剂为___,如图为在80℃时,pH对除杂的影响,通过加入试剂将pH调至___。
②往滤渣D中加入NaClO溶液,发生反应的离子方程式为:___。
(4)在步骤V中,若要从滤液E通过操作Y得到大颗粒的高纯六水氯化锶晶体,操作Y包含下列步骤中的某几项,请选择合适的操作并排序。(填相应步骤的字母)
滤液E→(_____)→(_____)→(_____)→抽滤→(_____)→(_____)
a.蒸发浓缩至有大量晶体析出
b.在过饱和溶液中加入晶种
c.6l.5℃以上减压蒸发浓缩
d.6l.5℃以下减压蒸发浓缩
e.往溶液中加入无水乙醇
f.在30℃真空烘箱中干燥
g.在室温下缓慢冷却结晶
h.用氯化锶饱和溶液洗涤晶体
I.用冷水洗涤晶体
(5)为侧定所制SrCl26H2O晶体的纯度,取1.12g实验制得的产物加水溶解,配成100mL溶液,用移液管取出25mL于锥形瓶中,滴入几滴K2CrO4
①判断滴定终点的现象为___;
②实验时未采用棕色滴定管滴定,会使测得的晶体纯度___(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热化学方程式____。
(2)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热化学方程式_____。
(3)已知下列热化学方程式:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol;
③2H2(g)+O2(g)=2H2O(l ) ΔH3=-571.6kJ/mol,
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热化学方程式C(s)+H2O(g) ![]() CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气完全反应生成一氧化碳气体和氢气,并吸热131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸热131.1kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
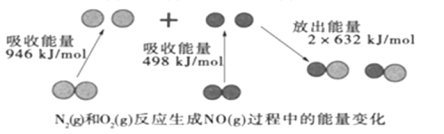
下列说法中正确的是( )
A.1molN2(g)和1molO2(g)完全反应放出的能量为180kJ
B.通常情况下,N2(g)和O2(g)混合能直接生成NO
C.1molN2(g)和1molO2(g)具有的总能量小于2molNO(g)具有的总能量
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列说法不正确的是( )
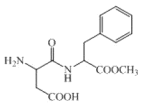
A.能使FeCl3溶液显紫色
B.该有机物不存在顺反异构
C.能发生取代反应和加成反应
D.1mol该有机物完全水解最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
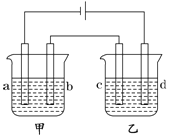
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com