
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )。
A.吸氢材料镧镍合金 B.半导体材料砷化镓
C.高温结构陶瓷材料氮化硅 D.透明陶瓷材料硒化锌
科目:高中化学 来源: 题型:
某温度时,在一个容积为2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
(1)该反应的化学方程式为____________________________________。
(2)反应开始至2 min,气体Z的反应速率为_____________________。
(3)若X、Y、Z均为气体,反应达到平衡时:
①压强是开始时的________倍;
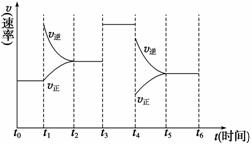 ②若此时将容器的体积缩小为原来的
②若此时将容器的体积缩小为原来的 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为________反应(填“放热”或“吸热”)。
(4)若上述反应在2 min后的t1~t6内反应速率与反应时间图像如右,在每一时刻均改变一个影响反应速率的因素,则( )
A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t2~t3时X的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: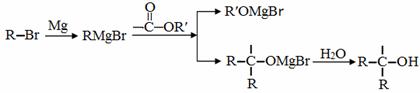
A是一种重要的化工原料,能使溴水反应褪色,且分子内所有的原子都在一条直线上,在不同的条件下,A可以转化为烃B和烃C,B和C的核磁共振氢谱中都只有一个吸收峰,B能使溴水反应褪色而C不能使溴水反应褪色。A~J分别代表一种有机物,并有如下的转化关系:
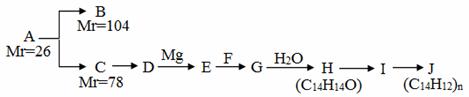
回答下列问题:
(1)A的结构简式为________________;
(2)B的结构简式为_________________;
(3)反应C→D所需要的试剂是_________________________;
(4)H不能发生催化氧化,H的结构简式是____________________________________;
(5) I中的官能团名称是___________________;
(6) I中可能含有的杂质是_____________________(写结构简式);
(7)写出I→J的反应方程式________________________________________________;
(8)H有多种同分异构体,符合下列条件的同分异构体有________种。
①能与FeCl3溶液显紫色;②有二联苯结构;③二联苯上有两个侧链。
其中核磁共振氢谱中吸收峰最少的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和应用均正确的是( )
A.NH3能氧化氮氧化物,可用于汽车尾气净化
B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料
D.Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色。
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是__________________。
②若要证明反应所得“铁块”中含有金属铝,可用____________(填化学式)溶液,所发生反应的离子方程式为__________________。
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为4H++4I-+O2===2I2+2H2O。该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的反应速率。已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75 ℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深。
实验小组拟用0.8 mol·L-1 KI溶液、0.1 mol·L-1 H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A、B、C三组实验,部分实验数据如下表:
| 编 号 | 温度 /℃ | H2SO4 体积 /mL | KI溶液 体积/mL | H2O体 积/mL | 淀粉溶液 /mL | 出现 蓝色 时间 /s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出 现蓝 色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
①为确保A组实验在39 ℃下进行,应采用的控温操作方法是______________________。
②A、B、C三组实验时,都加入了5 mL水,其目的是______________。
③B组实验中“没出现蓝色”,原因是______________。
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标。
⑤根据你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是
A.同周期元素的原子半径随着核电荷数的增大而增大
B.同主族元素的原子半径随着核电荷数的增大而增大
C.同周期元素的第一电离能随着核电荷数的增大而增大
D.同主族元素的第一电离能随着核电荷数的增大而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
对σ键的认识不正确的是( )
A.σ键不属于共价键,是另一种化学键
B.S-Sσ键与S-Pσ键的对称性相同
C.分子中含有共价键,则至少含有一个σ键
D.含有π键的化合物与只含σ键的化合物的化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
448 mL某气体在标准状况下的质量为0.64 g,该气体的摩尔质量约为( )
A.64 g B.64 C.64 g·mol-1 D.32 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2。
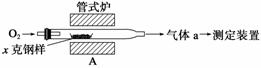
①气体a的成分是________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2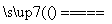 1________+3________。
1________+3________。
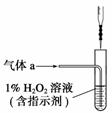
(2)将气体a通入测硫装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式
________________________________________________________________________
________________________________________________________________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液,若消耗1 mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
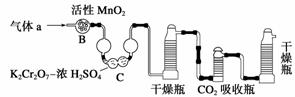
①气体a通过B和C的目的是_______________________________________________。
②计算钢样中碳的质量分数,应测量的数据是___________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com