
| 序号 | 物质 | 杂质 | 除杂应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,并过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉,并过滤 |
| ③ | H2 | CO2 | 通过盛NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| ④ | NaNO3固体 | CaCO3 | 溶解、过滤、蒸发 |
| A. | ①②③④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:实验题
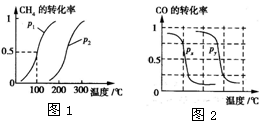 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.请回答下列问题:| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | $\frac{1}{3}$ | 0.1 |
| 2 | n | $\frac{1}{3}$ | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,11.2L Cl2含有的分子数小于0.5NA | |
| B. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA | |
| C. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| D. | 常温下,23 g NO2含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,使N2和H2在一定的条件下转化为NH3 | |
| B. | 收集氯气用排饱和食盐水的方法 | |
| C. | 加压条件下有利于SO2和O2反应生成SO3 | |
| D. | 可用浓氨水和氢氧化钠固体快速制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4=H2++SO42- | B. | Ba(OH)2=Ba2++OH - | ||
| C. | NaNO3=Na ++NO3- | D. | CuSO4=Cu+2+SO4-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
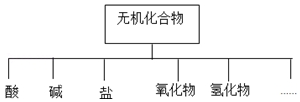
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①H2SO4 ② | ③NaOH ④ | ⑤Na2SO4 ⑥ | ⑦SO2 ⑧ | ⑨NH3 ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
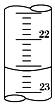 中和滴定的相关问题
中和滴定的相关问题| 滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Y的价电子轨道表示式为
;Y的价电子轨道表示式为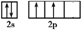 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com