
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下。下列说法正确的是
![]()
A. 该反应为加成反应,没有副产物生成
B. 可用酸性高锰酸钾溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. l mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:1:1
【答案】D
【解析】
丙烯酸不对称,与水加成时会出现两种产物;丙烯酸的碳碳双键容易被氧化,乳酸中的羟基相连C原子上有H原子,羟基易被氧化,可使酸性高锰酸钾褪色;丙烯酸和乳酸可发生酯化反应。
A.双键与水加成时,-OH可能在首端C原子上,可能混有副产物1-羟基丙酸,故A错误;
B.丙烯酸的碳碳双键容易被氧化,乳酸中的羟基相连C原子上有H原子,羟基易被氧化,可使酸性高锰酸钾褪色,无法区别丙烯酸和乳酸,故B错误;
C.丙烯酸含有羧基,乳酸含有羟基,可发生酯化反应,C错误;
D.乳酸含-OH、-COOH,均与Na反应,只有-COOH与NaOH、NaHCO3反应,则1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:1:1,D正确;
答案为D


科目:高中化学 来源: 题型:
【题目】下列化学用语书写错误的是
A. 2Al+6H+→2Al3++3H2↑B. HCO3- +OH-→CO32- +H2O
C. 2Fe2++Cl2→2Fe3++2Cl-D. CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.NaHSO4=2Na++HSO4-2B.CH3COOH=H++CH3COO-
C.Al2(SO4)3=2Al3++3SO42-D.NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A. 0.1mol·L-1(NH4)2SO4溶液中NH4+数目一定小于0.2NA
B. 标况下,3.2gN2H4中含有的N-H键的数目为0.4NA
C. 将1 molCl2通入水中,溶液中HClO、Cl-、ClO-粒子数之和为2NA
D. 1mol的CO2和H2O(g)的混合气体与过量Na2O2充分反应转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃的分子式为C9H12,已知苯环上的一氯取代物只有两种,下列说法中正确的是
A. 该有机物不能发生取代反应,但能发生加成反应
B. 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色
C. 该有机物分子中的所有原子可能在同一平面上
D. 该有机物的一氯取代物最多有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A. 定容时仰视刻度线和液面
B. 容量瓶中原有少量的蒸馏水
C. 移液时,不慎将液体流到瓶外
D. 容量瓶盛过KOH溶液,使用前未洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______________;
______________; ______________。
______________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。
BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业锅炉内壁的水垢,不仅浪费燃料,而且容易引发安全隐患。某碳素钢锅炉水垢(主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3、SiO2等)碱煮法清除的流程如下:

已知:20℃时几种难溶物的溶度积常数如下表(单位省略):

回答下列问题:
(1)“碱煮”环节,加入Na3PO4的主要目的是将CaSO4转化为Ca3(PO4)2,请写出该离子方程式______________________。
(2)“浸泡过程中,稀盐酸会溶解Fe2O3。溶解后的Fe2O3会加速锅炉腐蚀,故需“还原”处理。
①锅炉被加速腐蚀的原因是______________________;
②浸泡液还原”处理时,Sn2+转化为Sn4+,则反应中氧化剂与还原剂的物质的量之比为______________________。
(3)“钝化”处理的目的是在锅炉表面形成Fe3O4保护膜,同时生成可直接参与大气循环的气体。
①反应的离子方程式为_________________________________;
②为检验锅炉“钝化”处理后是否形成致密的保护膜,可往锅炉内壁刷上硫酸铜溶液。若观察到______________________(填现象),则保护膜致密性欠佳。
(4)柠檬酸(用H3R表示)可用作清除锅炉水垢的酸洗剂,溶液中H3R、H2R-、HR2-、R3-的含量与pH的关系如图所示。由此可推知,0.1 mol ·L-1 Na2HR溶液中各种阴离子浓度由大到小的排列顺序为______________________。
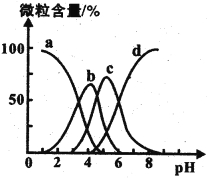
(5)用如图装置对锅炉用水(含Ca2+、Mg2+、HCO3-)进行预处理,可有效防止水垢形成。电解时,Ca2+形成沉淀的电极反应式为______________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com