
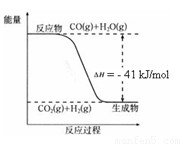
��֪��ҵ�������ķ�ӦΪCO(g) + H2O(g)  CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2
L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2
L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
��1������H2O(g)��Ũ�ȣ�CO��ת���ʽ� ���������С�����䡱����
��2��ƽ�ⳣ���ı���ʽK �� ��400 ��ʱ��ƽ�ⳣ��K 9���>����<����=������
��3��500 ��ʱ��10 min��v(H2O)�� ���ڴ˹�������ϵ�������� ������ӡ����١��� kJ��
��4����֪ 2H2 (g) + O2 (g) = 2H2O (g) ��H����484 kJ/mol
�����ͼд��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
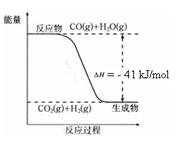
��֪��ҵ�������ķ�ӦΪCO(g) + H2O(g) ![]() CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2 L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2 L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
��1������H2O(g)��Ũ�ȣ�CO��ת���ʽ� ���������С�����䡱����
��2��ƽ�ⳣ���ı���ʽK �� ��400 ��ʱ��ƽ�ⳣ��K 9���>����<����=������
��3��500 ��ʱ��10 min��v(H2O)�� ���ڴ˹�������ϵ�������� ������ӡ����١��� kJ��
��4����֪ 2H2 (g) + O2 (g) = 2H2O (g) ��H����484 kJ/mol
�����ͼд��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��ҵ�������ķ�ӦΪCO(g) + H2O(g) CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
��1������H2O(g)��Ũ�ȣ�CO��ת���ʽ� ���������С�����䡱����
��2��ƽ�ⳣ���ı���ʽK �� ��400 ��ʱ��ƽ�ⳣ��K 9���>����<����=������
��3��500 ��ʱ��10min��v(H2O)�� ���ڴ˹�������ϵ�������� ������ӡ����١��� kJ��
��4����֪ 2H2 (g) + O2 (g) = 2H2O(g) ��H����484kJ/mol
�����ͼд��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011�챱���г�����������һѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��֪��ҵ�������ķ�ӦΪCO(g) + H2O(g)  CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2 L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��
CO2(g) + H2(g)����Ӧ�����������仯����ͼ��ʾ����500 ��ʱ��ƽ�ⳣ�� K = 9������2 L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0.1 mol/L��10 minʱ�ﵽƽ��״̬��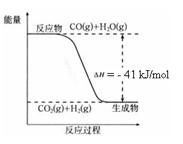
��1������H2O(g)��Ũ�ȣ�CO��ת���ʽ� ���������С�����䡱����
��2��ƽ�ⳣ���ı���ʽK �� ��400 ��ʱ��ƽ�ⳣ��K 9���>����<����=������
��3��500 ��ʱ��10 min��v(H2O)�� ���ڴ˹�������ϵ�������� ������ӡ����١��� kJ��
��4����֪ 2H2 (g) + O2 (g) = 2H2O (g) ��H����484 kJ/mol
�����ͼд��CO��ȫȼ������CO2���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��������ĩ�� ���ͣ������
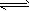 CO2(g)+H2(g)����Ӧ�����������仯��ͼ��ʾ����500 ��ʱ��ƽ�ⳣ��K=9������2L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0��1mol/L��10minʱ�ﵽƽ��״̬��
CO2(g)+H2(g)����Ӧ�����������仯��ͼ��ʾ����500 ��ʱ��ƽ�ⳣ��K=9������2L���ܱ�������CO��ˮ��������ʼŨ�ȶ���0��1mol/L��10minʱ�ﵽƽ��״̬�� 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com