
| n |
| V |


科目:高中化学 来源: 题型:
| A、锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| B、日本福岛核电站爆炸时释放的两种放射性核素13153I与13755Cs的中子数相等 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(Ca2+) |
| c(Mg2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
| 4 |
| Vt1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| AlT/(mol?L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
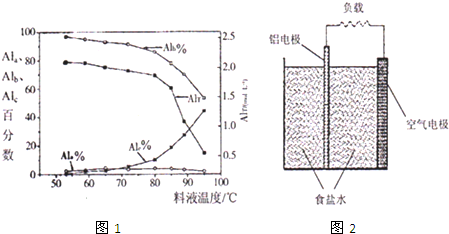
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、用燃着的酒精灯去点燃另一只酒精灯 |
| B、不慎把浓硫酸洒在皮肤上要立即用NaOH溶液冲洗 |
| C、做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸 |
| D、盛放盐酸的试剂瓶上要贴上如右图的标志 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com