

| A. | 浓硫酸的还原产物是SO2 | |
| B. | 该装置可随时控制反应的发生或停止 | |
| C. | ①中有白色固体生成,加水后溶液呈蓝色 | |
| D. | ②中盛放Ba(NO3)2溶液可吸收SO2,防止空气污染 |
分析 A.铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水;
B.通过移动可移动的铜丝,可以控制反应的开始与停止;
C.试管①中有生成硫酸铜,溶液呈蓝色;
D.二氧化硫与硝酸钡溶液反应生成一氧化氮有毒气体.
解答 解:A.铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,所以浓硫酸的还原产物是SO2,故A正确;
B.当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触则反应停止,可通过上下移动①中铜丝可控制SO2的量,故B正确;
C.试管①中有生成硫酸铜,溶液呈蓝色,故C错误;
D.二氧化硫与硝酸钡溶液反应生成一氧化氮有毒气体,能够引起空气污染,故D错误;
故选:CD.
点评 本题考查化学实验评价及物质的性质,为高频考点,把握实验装置的作用、反应原理、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在加热条件下能使不活泼金属铜溶解,表现出浓硫酸的强氧化性和酸性 | |
| B. | 可以用铁制或铝制容器贮运,表现出浓硫酸有稳定的化学性质 | |
| C. | 能使胆矾晶体由蓝色变为白色,表现出浓硫酸的脱水性 | |
| D. | 能使蔗糖炭化,表现出浓硫酸的吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
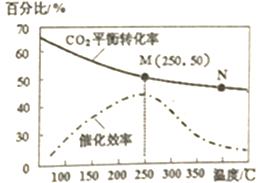 一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )
一定条件下合成乙烯6H2(g)+2C02(g)$\frac{\underline{\;催化剂\;}}{\;}$CH2=CH2(g)+4H20(g);己知温度对C02的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)一定小于v(N) | |
| B. | 平衡常数:KM<KN | |
| C. | 催化剂对CO2的平衡转化率没有影响 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
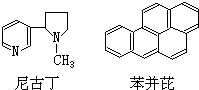 吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:
吸烟是人类的一种不良嗜好,也是生活环境中的特殊大气污染源,它对人体健康危害极大,据分析吸烟生成的物质至少有700多种,其中大部分为有毒有害物质.危害最大的物质中有两种是尼古丁和苯并芘,前者的成人致死量约为40~60mg,相当于一包香烟产生的尼古丁的总量;后者是最强的致癌物之一.它们的结构简式分别为:| A. | 尼古丁的分子式为C10H14N2 | |
| B. | 尼古丁分子中的所有原子都在同一平面上 | |
| C. | 苯并芘的分子式为C20H18 | |
| D. | 苯并芘分子中含有苯环结构单元,是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
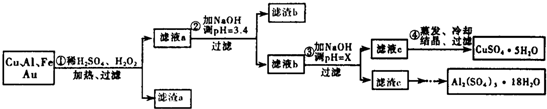
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com