
 某同学取一定量Fe与Al的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅NH4NO3一种.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
某同学取一定量Fe与Al的混合物与一定量极稀的硝酸充分反应,已知硝酸的还原产物仅NH4NO3一种.在反应结束后的溶液中,逐滴加入4mol?L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:| 0.012mol×8-0.008mol×3 |
| 3 |
| 0.096mol |
| 4mol/L |


科目:高中化学 来源: 题型:
| 实验操作及现象 | 实验结论 | |
| A | 分别向2 mL 0.1 mol?L-1 CH3COOH溶液和2 mL 0.1 mol?L-1 H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性: CH3COOH>H2CO3>H3BO3 |
| B | 向浓度均为0.1 mol?L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
| C | 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 | 证明生成了乙烯 |
| D | 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 | 氧化性:Br2>I2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、“84”消毒液中有效成分NaClO的电子式: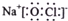 |
B、食盐中阴离子的核外电子排布式: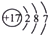 |
C、聚丙烯的结构简式: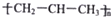 |
| D、电解时铁作阳极的电极反应式:Fe一3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲烷的爆炸极限 | 空气中 | 纯氧气中 |
| 5.0%~15% | 5.0%~60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | CO2 | SO2 | Ba(NO3)2 |
| ③ | NO2 | SO2 | BaCl2 |
| ④ | CO2 | NH3 | CaCl2 |
| A、②③④ | B、①②③ |
| C、①②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热至沸腾 |
| B、加少量NaOH |
| C、加100ml水 |
| D、加20ml0.4mol/LNH3?H2O溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com