
| A. | ①②③ | B. | ①③⑥ | C. | ②③⑥ | D. | ③④⑤ |
分析 醋酸是弱电解质,溶液中存在电离平衡,若c(H+)相同的醋酸和盐酸,醋酸浓度大于盐酸,等浓度等体积的醋酸和盐酸,n(CH3COOH)>n(HCl),反应速率与氢离子浓度成正比,氢离子浓度越大反应速率越快,则反应时间越短,生成氢气的质量相等,根据氢气和锌之间的关系式知,需要锌的物质的量相等.
解答 解:①若c(H+)相同的醋酸和盐酸,醋酸是弱电解质,随着反应的进行醋酸不断电离出氢离子,氯化氢完全电离,所以反应过程中,醋酸中氢离子始终大于盐酸,则醋酸反应速率大于盐酸,所以醋酸反应所需要的时间小于盐酸,故错误;
②两种溶液中氢离子浓度相等,所以开始时两种溶液反应速率相等,故错误;
③根据氢气和锌之间的关系式知,生成相同质量的氢气需要的锌的质量相等,故正确;
④根据①知,反应过程中醋酸平均反应速率大于盐酸,故正确;
⑤氢离子浓度、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,所以盐酸中锌有剩余,故正确;
⑥根据⑤知,醋酸过量,则醋酸有剩余,锌完全反应,故错误;
故选D.
点评 本题考查了强弱电解质的电离,明确弱电解质电离特点是解本题关键,结合氢离子浓度与反应速率的关系来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、OH- | B. | Na+、Mg2+、OH-、NO3- | ||
| C. | Na+、H+、CO32-、Fe2+ | D. | Mg2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
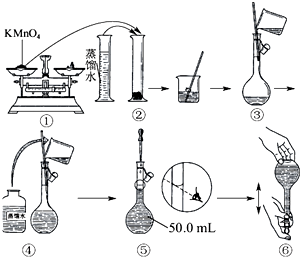 人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.
人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L CH3COONa溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH增大和KW不变 | |
| C. | 一定温度下,pH=6的HCl溶液和pH=6的NH4Cl溶液中,c(H+)相等 | |
| D. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH(aq)+HNO3(aq)═NaNO3(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| B. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0kJ/mol(燃烧热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.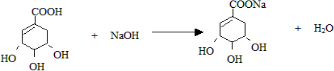 .
. -COOH),其反应类型是c
-COOH),其反应类型是c查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 ,B所含的阳离子是Ba2+.
,B所含的阳离子是Ba2+.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
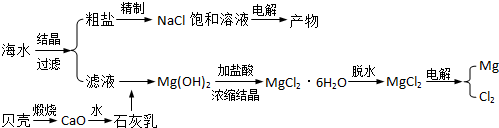
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com