
| 元素名称 | 氟 | 氧 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
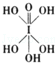 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)分析 (1)溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子;
(2)根据氢键分析解答;
(3)元素的第一电离能越大,元素失电子能力越弱,得电子能力越强,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子;
(4)根据含氧酸中,酸的元数取决于羟基氢的个数,含非羟基氧原子个数越多,酸性越强;
(5)I3-离子的中心原子周围σ键电子对对数为2,孤电子对个数=$\frac{1}{2}$(7+1-2×1);
(6)等电子体是具有相同的价电子数和相同原子数的微粒.
解答 解:(1)溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,所以其价电子排布式为:4s24p5,故答案为:4s24p5;
(2)HF分子之间存在氢键,使氢氟酸分子缔合,故答案为:氢键;
(3)卤族元素包含:F、Cl、Br、I、At元素,元素的第一电离能越小,元素失电子能力越强,得电子能力越弱,则越容易形成阳离子,根据表中数据知,卤族元素中第一电离能最小的是I元素,则碘元素易失电子生成简单阳离子,故答案为:碘(I);
(4)H5IO6(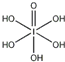 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:HIO4>H5IO6,
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:HIO4>H5IO6,
故答案为:<;
(5)(5)I3-离子的中心原子周围σ键电子对对数为2,孤电子对个数=$\frac{1}{2}$(7+1-2×1)=3,故答案为:2;3;
(6)等电子体具有相同的电子数目和原子数目的微粒,所以与CO2互为等电子体的分子为CS2、N2O等,故答案为:CS2、N2O.
点评 本题考查物质结构与性质,比较综合,涉及元素核外电子排布、分子结构与性质、酸性强弱比较、等电子体等,侧重对主干知识的考查,需要学生熟练掌握基础知识,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
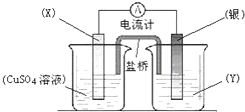 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
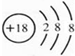 .
.| 实验步骤 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差一个或几个CH2原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质 | |
| B. | 不带支链的烃,其分子是直线形的 | |
| C. | 甲烷是烷烃中碳含量最低的,也是组成最简单的烃 | |
| D. | 分子式为C4H10的烃有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
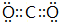 ,B与D形成的原子个数比为1:1的化合物的电子式是
,B与D形成的原子个数比为1:1的化合物的电子式是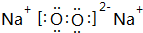 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、取代反应
、取代反应 、加聚反应
、加聚反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com