
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的,请回答:
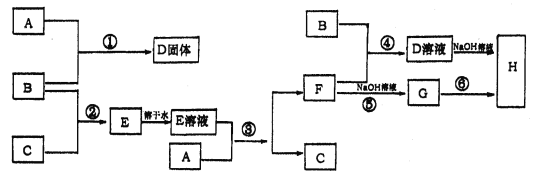
(1)A是_____________,B是______________,C是___________(填化学式)
(2)反应⑥的化学方程式为:__________________________________________。
(3)反应④的离子方程式为:__________________________________________。
【答案】Fe Cl2 H2 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl-
【解析】
由B为黄绿色气体且为单质,可知B为Cl2;由框图可知反应生成的固体D为固体单质A与Cl2反应生成的一种氯化物;反应生成的E为Cl2与气体单质C生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物,所以A为变价金属,应为Fe,所以A为Fe,B为Cl2,C为H2,D为FeCl3,E为HCl,F为FeCl2,G为Fe(OH)2,H为Fe(OH)3。
(1)A是Fe,B是Cl2,C是H2,故答案为:Fe ; Cl2 ; H2 ;
(2)Fe(OH)2在很容易氧化,反应⑥的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)亚铁离子能被氯气氧化成铁离子,反应④的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;故答案为:2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
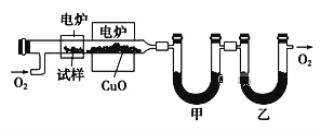
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收。2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3(如图Ⅰ)
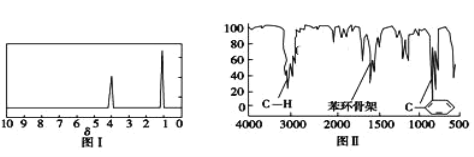
步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为_____。
(2)X的分子式为_____;X的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中.正确的是( )
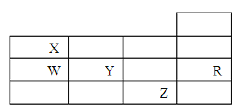
A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
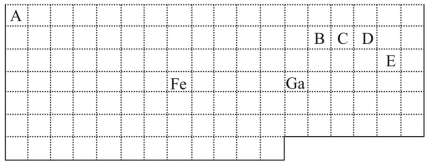
根据信息回答下列问题:
(1)周期表中基态Ga原子的电子排布式为___。
(2)Fe元素位于周期表的___分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为___。
(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为___和___(填化学式)。在CO、CH3OH中,碳原子采取sp3杂化的分子有___。
(4)根据VSEPR理论预测ED4-离子的空间构型为___。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子有__(任写2种化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质变化,只与范德华力有关的是___。
A.干冰熔化 B.乙酸汽化 C.乙醇溶于水 D.碘溶于四氯化碳
(2)下面是s能级与p能级的原子轨道图:
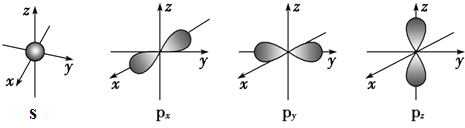
请回答下列问题:
s电子的原子轨道呈__形,每个s能级有__个原子轨道;p电子的原子轨道呈___形,每个p能级有___个原子轨道.
(3)Na、Mg、Al第一电离能的由大到小的顺序:___。
(4)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列:
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是_______________。
(2)装置B中盛有的试剂是:____________;装置D的作用是________________。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为____________________________。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。

①pH过低或过高均导致产率下降,其原因是_____________________;
②柠檬酸的作用还有________________________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,2mol X和3mol Y进行反应:X(g)+Y(g)![]() Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.05 mol/(Ls)
B. 其他条件不变,增大X的浓度,平衡右移,X的转化率增大
C. 其他条件不变,12s后将容器体积扩大为10L,Z的平衡浓度变为0.06mol/L
D. 其他条件不变,若移走1molX和1.5molY,再达平衡时Z的物质的量小于0.3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com