
 .
. 分析 (1)测得A管质量增加了2.16g,B管质量增加了9.24g,分别为水、二氧化碳的质量,结合质量守恒定律计算消耗氧气的质量;
(2)根据n=$\frac{m}{M}$计算有机物、水、二氧化碳的物质的量,根据原子守恒计算有机物的分子式;
(3)有机物含有苯环,且苯环上有两个取代基,结合有机物分子式判断取代基,有邻、间、对三种;苯环上一氯代物只有两种的结构简式,苯环上含有2种H原子,应是两个不同的取代基处于对位.
解答 解:(1)测得A管质量增加了2.16g,B管质量增加了9.24g,分别为水、二氧化碳的质量,由质量守恒定律计算消耗氧气的质量为2.16g+9.24g-3.24g=8.16g,
故答案为:8.16g;
(2)试管A质量增加2.16g为生成水的质量,其物质的量=$\frac{2.16g}{18g/mol}$=0.12mol,碱石灰吸CO2增加9.24g,即生成二氧化碳的物质的量=$\frac{9.24g}{44g/mol}$=0.21mol,该有机物物质的量为=$\frac{3.24g}{108g/mol}$=0.03mol,
所以有机物分子中,N(C)=$\frac{0.21mol}{0.03mol}$=7,N(H)=$\frac{0.012mol}{0.03mol}$=8,N(O)=$\frac{108-12×7-8}{16}$=1,
所以有机物的分子式为:C7H8O,
故答案为:C7H8O;
(3)若该有机物含有苯环,应含有1个苯环,C7H8O的不饱和度=$\frac{2×7+2-8}{2}$=4,侧链不含不饱和键,苯环上有两个取代基,侧链有2个,为-OH、-CH3,有邻、间、对三种位置关系,故符合条件的有机物的结构简式为: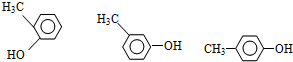 ;其中苯环上一氯代物只有两种的结构简式,两个不同的取代基处于对位,符合条件的有机物为
;其中苯环上一氯代物只有两种的结构简式,两个不同的取代基处于对位,符合条件的有机物为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,为高频考点,把握质量守恒、原子守恒为计算的关键,注意有机物的结构及性质来解答该题,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 粒子代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
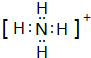 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| B. | 温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw变小 | |
| C. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| D. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 研究目的 | 温度(T) 对反应的影响 | 压强(p)对平衡常数的影响 | 压强(p)对反应的影响(p2>p1) | 温度(T)对反应的影响(T1>T2) |
| 图示 | 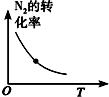 | 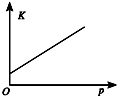 | 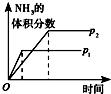 |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| C. | 加水稀释CH3COONa溶液,溶液中$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$的值变小 | |
| D. | 25℃时,pH=4的盐酸与pH=4的醋酸溶液等体积混合后pH=4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com