
【题目】将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu===2FeCl2+
CuCl2。
(1)请用双线桥法标出电子转移的方向和数目___________________________。
(2)当有0.3 mol电子发生转移时,发生反应的Cu的质量为_________。
(3)请将以上反应改写为离子方程式___________________。
(4)配平下列方程式: FeCl2+ H2O2+ HCl=== FeCl3+ H2O。
(5)高锰酸钾和氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O,若消耗15.8 g氧化剂KMnO4,则被氧化的还原剂的质量是_______。
【答案】(1)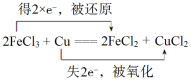 (3分)
(3分)
(2)9.6 g(2分)
(3)2Fe3++Cu===2Fe2++Cu2+(3分)
(4)2 1 2 2 2(共2分)
(5)40.5 g(3分)
【解析】(1)FeCl3中Fe的化合价降低,FeCl3作氧化剂,还原产物是FeCl2,Cu的化合价升高,Cu作还原剂,CuCl2作氧化产物,用双线桥表示电子转移方向和数目是 。
。
(2)本题考查氧化还原反应的计算,转移2 mol电子时消耗铜的质量为64 g,因此转移0.3 mol电子,消耗Cu的质量为0.3×64/2 g=9.6 g。
(3)本题考查离子方程式的书写,FeCl3、FeCl2、CuCl2都是可溶性的盐,完全电离,因此离子反应方程式为Cu+2Fe3+===Cu2++2Fe2+。
(4)本题考查氧化还原反应方程式的配平,FeCl2中Fe的化合价由+2价→+3价,化合价升高1价,H2O2中O的化合价由1价→2价,化合价整体降低2价,最小公倍数为2,再根据原子守恒配平其他,可得2FeCl2+H2O2+2HCl===2FeCl3+2H2O。
(5)根据得失电子守恒进行计算,15.8 g×5/158 g·mol1=n(HBr)×1,解得被氧化的n(HBr)=0.5 mol,m(HBr)=0.5×81 g=40.5 g。


科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)铟与镓同是ⅢA族元素,写出铟基态原子的电子排布式:_________。
(2)硒为第4周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由小到大的顺序为____。(用元素符号表示)
(3)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。该离子中含有化学键的类型有__(填序号);向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的晶胞结构如图乙所示。写出该反应的离子方程式:__________。
A.极性键 B.离子键 C.非极性键 D.配位键

(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜铟硒薄膜电池等。其中元素P、As、Se第一电离能由小到大的顺序为:______。
(5)已知由砷与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其晶胞结构如图所示,请写出化合物A的化学式____;化合物A可由(CH3)3Ga和AsH3在700 ℃下反应制得,反应的化学方程式为______________。设化合物A的晶胞边长为apm,则每立方厘米该晶体中所含砷元素的质量为____g(用NA表示阿伏加德罗常数的值)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、氮氧化物(NOx)严重影响人们的生活和健康,化学工作者对氮氧化物的处理做了广泛而深人的研究。
I.利用甲烷还原NOx
①CH4(g)+4N02(g)=4NO(g)+C02(g)+2H2O(g) △H1=-574kJ/mol;
②CH4(g)+4N0(g)=2N2(g)+C02(g)+2H2O(g) △H2=-1160kJ/mol。
(1)甲烷直接将N02 还原为N2的热化学方程式为_________。
(2)在恒容(2L)密闭容器中充入lmolCH4和2molNO2进行(1)中反应,CH4的平衡转化率![]() (CH4)与温度和压强的关系如图甲所示。
(CH4)与温度和压强的关系如图甲所示。

①若容器中的压强为p2, y点:v正_____v逆(填“大于”“等于”或“小于”)。
②图中压强由大到小为______,理由是____________________。
③ x 点对应温度下反应的平衡常数K=________。
II.某研究小组以Ag—ZSM—5为催化剂模拟汽车尾气的处理,实现NO和CO反应转化为无毒气体,同时利用反应放出的热量预热NO和CO。实验测得NO的转化率随温度的变化如图乙所示。
(1)低于773K时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是_______,高于773K,NO的转化率降低的可能原因是______(填序号)。
A.平衡常数变大 B.催化剂的活性降低 C.反应活化能增大
(2)为提高汽车尾气中NO的转化率,除了改变温度、压强外,还可以采取的措施有____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃
B.淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖
C.溴水中滴加裂化汽油,溶液褪色且分层
D.皂化反应是指油脂在稀硫酸的作用下水解得到高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维。其单体之一——芥子醇结构简式如下图所示,下列有关芥子醇的说法正确的是( )

A. 芥子醇分子中有两种含氧官能团
B. 芥子醇分子中所有碳原子不可能在同一平面上
C. 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2
D. 芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示。下列说法正确的是( )

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ。
C. Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作先后顺序正确的是:
A. 先装好药品,再检查装置的气密性
B. 结束氢气还原氧化铜的实验时,先停止通氢气后熄灭酒精灯
C. 先将导管插入水中,再用双手握紧试管检查装置气密性
D. 稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水蕴藏着丰富的资源。下列有关海水综合利用的说法中,不正确的是
A.从海水中可提取食盐B.海水蒸馏可得淡水
C.直接电解海水可得镁D.从海水中可提取溴
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com