
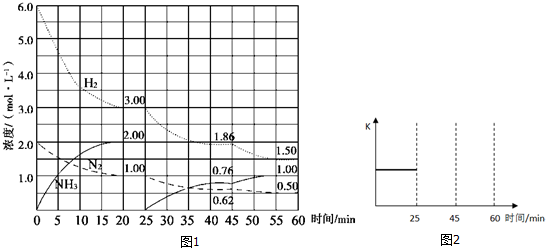
分析 (1)根据图示数据得出第一次达到平衡时反应物和生成物浓度,再根据平衡常数的表达式计算出第一次平衡时平衡常数K;
(2)25min时氨气的浓度为0、氢气和氮气的浓度逐渐减小,据此进行分析改变的条件;
(3)根据45min时氢气、氮气浓度减小、氨气浓度增加进行判断;
(4)根据反应速率的表达式:v=$\frac{△c}{△t}$,时间变化都是5min,根据浓度变化判断v1、v2、v3;
(5)根据表中达到平衡状态时氢气的浓度计算出氢气的转化率,然后判断H2在三次平衡阶段的平衡转化率大小;
(6)平衡常数和温度有关,放热反应,温度越高,K越小,温度越低,K越大.
解答 解:(1)第一次达到平衡常数时,氨气的浓度为:2.00mol/L,氢气浓度为:3.00mol/L,氮气的浓度为1.00mol/L,第一次平衡时平衡常数K=$\frac{2.0{0}^{2}}{1.00×3.0{0}^{2}}$≈0.15,
故答案为:0.15;
(2)25min时生成物氨气的物质的量浓度为0、氮气和氢气的浓度逐渐减小,说明从反应体系中移出产物氨气,平衡向着正向移动,故答案为:正反应方向移动;移走生成物NH3;
(3)45min时,氨气的浓度增大,氮气、氢气的浓度减小,化学平衡平衡向着正向移动,该反应是放热反应,说明降低了温度,
故答案为:降低温度;
(4)由图可知,5~10min氨气的浓度变化大于0.5mol/L,25~30min氨气浓度变化约为0.5mol/L,45~50min氨气的浓度变化为(1.0-0.76)mol/L=0.24mol/L,时间变化为5min,由v=$\frac{△c}{△t}$可知,反应速率关系为:v1>v2>v3,
故答案为:v1>v2>v3;
(5)第一次平衡时氢气的转化率为:$\frac{6.0-3.0}{6.0}$×100%=50%,第二次平衡时氢气的转化率为:$\frac{3.00-1.86}{1.86}$×100%=38%,第三次达到平衡时氢气的转化率为:$\frac{1.86-1.50}{1.86}$×100%≈19.4%,显然第三次氢气的转化率最低,即最小的是α3,
故答案为:α3;
(6)平衡常数和温度有关,放热反应,温度越高,K越小,温度越低,K越大,25~45、45~60min 两阶段化学平衡常数K的变化图象如下: ,故答案为:
,故答案为: .
.
点评 本题考查考生对化学反应速率概念,化学平衡的了解及其影响因素的理解,对化学平衡常数简单计算的掌握,注重考查学生知识迁移、读图及表达能力.


科目:高中化学 来源: 题型:多选题
| A. | 氢氧化镁、氢氧化钾、氢氧化铁、氢氧化镁等碱不溶于水,统称为难溶性碱 | |
| B. | 科学家合成和分离了超过4500万种物质.尿素是第一个人工合成的无机化合物,尿素的合成是无机化学发展过程中的重要里程碑和分水岭 | |
| C. | 金刚石、食盐、冰都属于晶体,有固定熔沸点,而石蜡、玻璃属于非晶体,一般不具备规则的几何外形 | |
| D. | 固体微粒排列紧密,在固定的位置上振动,几乎不能被压缩,而液体微粒可自由移动,易被压缩 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 纯碱 | Al(OH)3胶体 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 小苏打 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | B. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$ 2 Fe+3CO2 | D. | MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明Fe2+既有氧化性又有还原性 | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子吸收光谱可用于测定物质中的金属元素,红外光谱可用于测定化合物的官能团 | |
| C. | 阴极射线、a粒子散射实验及布朗运动发现都对原子模型建立做出了贡献 | |
| D. | 常温常压下2g氦气含有的质子数与31g白磷中含有的P-P键数不一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1.01×105Pa时,测得该液体的沸点是100℃ | |
| B. | T℃时,测得该液体的c(OH-)=$\sqrt{Kw}$mol/L | |
| C. | 电解该液体时,得到H2和O2体积比为2﹕1(相同条件) | |
| D. | 该液体能与乙醇以任意比互溶,且能与钠剧烈反应放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
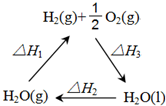 盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀的正极反应:2H++2e-═H2↑ | |
| B. | 钢铁发生吸氧腐蚀的负极反应:Fe-3e-═Fe3+ | |
| C. | 自行车的钢圈上镀一层铬,防止生锈 | |
| D. | 外加直流电源保护钢闸门时,钢闸门与直流电源的负极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com