
| A. | 需用托盘天平称取NaOH固体19.6g | |
| B. | 氢氧化钠固体溶解之后迅速转移至容量瓶中,以防变质 | |
| C. | 加蒸馏水至离刻度线1~2cm时改用胶头滴管定容 | |
| D. | 容量瓶使用前没有干燥会使所配溶液浓度偏低 |
分析 A.配制490mL1.0mol•L-1的NaOH溶液,实际应选择500mL容量瓶,依据m=CVM计算需要溶质的质量;
B.依据容量瓶使用注意事项解答;
C.依据定容的正确操作解答;
D.定容时,需要向容量瓶中加入蒸馏水,所以容量瓶使用前不需要干燥.
解答 解:A.配制490mL1.0mol•L-1的NaOH溶液,实际应选择500mL容量瓶,需要溶质的质量m=1.0mol/L×0.5L×40g/mol=20.0g,故A错误;
B.容量瓶为精密仪器,不能盛放过热液体,且只有在室温下体积才准确,所以应冷却后再移液,故B错误;
C.定容时,为防止加水过多,加蒸馏水至离刻度线1~2cm时改用胶头滴管逐滴滴加,故C正确;
D.定容时,需要向容量瓶中加入蒸馏水,所以容量瓶使用前不需要干燥,故D错误;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及容量瓶使用方法是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在BF3、NaCl3分子中,所有原子都满足8电子稳定机构 | |
| B. | P4和CH4空间结构相同,其具有的化学键类型也完全相同 | |
| C. | Cl-的结构示意图可表示为 | |
| D. | COS的电子式可表示为 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
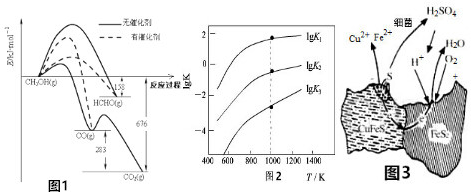
| 相关反应 | 反应热 | 平衡常数K |
| ①FeS2(s)+H2(g)?FeS(s)+H2S(g) | △H1 | K1 |
| ②$\frac{1}{2}$FeS2(s)+H2(g)?$\frac{1}{2}$FeS(s)+H2S(g) | △H2 | K2 |
| ③FeS(s)+H2(g)?Fe(s)+H2S(g) | △H3 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
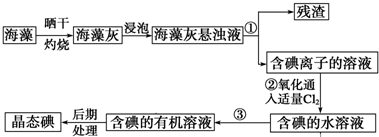
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题:
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化.为了验证该结论,学生设计了如图所示的实验装置进行实验(夹持装置略去).请回答下列问题: HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑(用化学方程式表示)
HCl+HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑(用化学方程式表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com