
【题目】下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是
A.C2H2和C6H6
B.C2H6和C2H5OH
C.C2H4和C2H6O
D.C6H6和C7H6O2
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
C.常温常压下,NA个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 molL-1的MgCl2溶液中含有Cl﹣个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止,煤不但是人类使用的主要能源,也是重要的化工原料。如图是以煤为原料合成聚苯乙烯塑料的流程。
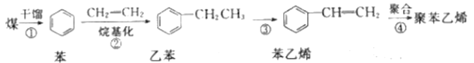
(1)苯在一定条件与Cl2反应可生成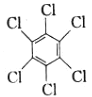 ,该反应类型为___(填“取代”或“加成”)反应;
,该反应类型为___(填“取代”或“加成”)反应;
(2)如图流程中原子利用率为100%的反应是___(填字母);
A.①③ B.②④
(3)能使酸性高锰酸钾溶液褪色的是___(填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学脱硫技术是一种温和的净化技术,其基本原理为利用阳极反应产生的羟基自由基(·OH,氧元素为-1价)将燃煤中的含硫物质氧化除去,其装置示意图如图所示。
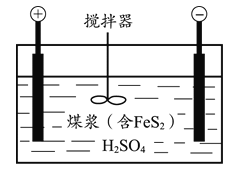
(1)将煤打成煤浆加入电解槽的目的是________。
(2)阳极的电极反应式为________。
(3)补全用羟基自由基除去煤中二硫化亚铁(FeS2)的反应的离子方程式:FeS2 +·OH =Fe3+ + SO42- + H2O +___。
(4)利用上述装置对某含FeS2的煤样品进行电解脱硫,测得一定时间内随溶液起始pH的改变脱硫率(溶于水中的硫元素质量占煤样中硫元素总质量的百分比)的变化如下图所示。

pH大于1.5后脱硫率下降的可能原因有:随着pH的升高,反应物的氧化性或还原性降低;________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
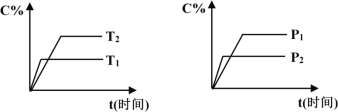
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-Q(Q>0)。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g)△H=-Q(Q>0)。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)写出该反应的平衡常数表达式____________________。
(2)前2s内的平均反应速率υ(N2)=__________;达到平衡时,CO的转化率为___________。
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,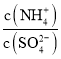 的值将_______(填 “变大”、“不变”或“变小”)。
的值将_______(填 “变大”、“不变”或“变小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀。用电离平衡原理解释上述现象。_______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种食盐包装标签上的文字。
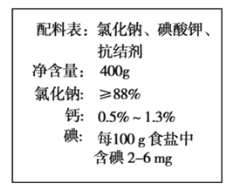
(1)标签上碘含量中,碘是指__________(填字母序号)。
A.碘元素 B.碘单质 C.碘离子 D.碘酸盐
(2)完成实验:配制![]()
![]() 的
的![]() 溶液。
溶液。
①实验所需的玻璃仪器有烧杯、玻璃棒、量筒、_______、胶头滴管。
②向容量瓶中加入蒸馏水,直到液面距瓶颈刻度线下![]() 时,改用胶头滴管滴加蒸馏水至液面的最低点与刻度线______________,盖好瓶塞,反复上下颠倒,摇匀。
时,改用胶头滴管滴加蒸馏水至液面的最低点与刻度线______________,盖好瓶塞,反复上下颠倒,摇匀。
③配制好的溶液__________(填“能”或“不能”)长期存放在容量瓶中。
(3)下列操作中,会导致所配溶液浓度偏低的是___________(填字母序号)。
A.转移溶液至容量瓶后,未洗涤烧杯和玻璃棒
B.移液时容量瓶中有少量蒸馏水
C.摇匀后发现液面低于容量瓶刻度线,但未补加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com