
| A. | 碱金属都可以保存在煤油中 | |
| B. | 碱金属元素的单质硬度小、密度小、熔点低 | |
| C. | 在空气中加热均可生成多种氧化物 | |
| D. | 碱金属与水反应,均漂浮在水面上 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:解答题
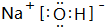 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | H2SO4 | C. | HClO4 | D. | MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列有关叙述正确的是( )
没有抗癌作用,对此下列有关叙述正确的是( )| A. | 两者互为同分异构体,都是以Pt原子为中心的四面体结构 | |
| B. | 两者互为同分异构体,都是以Pt原子为中心的平面结构 | |
| C. | 两者为同一物质,都是以Pt原子为中心的四面体结构 | |
| D. | 两者为同一物质,都是以Pt原子为中心的平面结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K层电子数为偶数的所有元素所在族的序数与该元素原子的K层电子数相等 | |
| B. | L层电子数为奇数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| C. | L层电子数为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | M层电子数为偶数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| m | n | ||
| x | y |
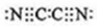 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.
,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为2NaOH+(CN)2=NaCN+NaOCN+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该化合物属于离子化合物.
,该化合物属于离子化合物.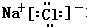 、
、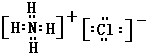 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤>②>①>③>④ | B. | ⑤>④>③>②>① | C. | ⑤>②>①>④>③ | D. | ②>①>⑤>④>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com