
(9分)现有含NaCL、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现CL-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
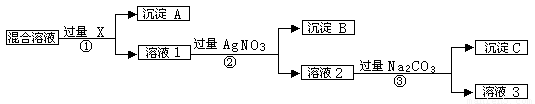
请回答下列问题:
⑴写出实验中下列物质的化学式:试剂X :_______,沉淀A:_______,沉淀B:______。
⑵上述实验流程中加入过量的Na2CO3的目的是___________________________________。
⑶按此实验方案得到的溶液3中肯定含有___________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________ ,之后若要获得固体NaNO3需进行的实验操作是________________(填操作名称)。
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象和结论 |
| 步骤1:用量筒取样品溶液2mL于试管中,再滴加足量的2mol/L盐酸,充分振荡,观察 | 若 溶液由无色变黄色 溶液由无色变黄色 ,则假设1可能成立;若溶液无明显变化 溶液无明显变化 ,则假设2可能成立 假设2可能成立 . |
| 步骤2:往步骤1 的试管中加入 1mL苯 1mL苯 ,充分振荡,观察 |
若溶液分层,上层有机层出现橙色或橙红色,则假设2成立; 若溶液只分层,无颜色变化,则假设1成立 若溶液分层,上层有机层出现橙色或橙红色,则假设2成立; 若溶液只分层,无颜色变化,则假设1成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:022
晶胞是晶体中最小重复单位,并在空间不断伸展构成晶体。NaCl晶体是一个正六面体(如图)。我们把阴、阳离子看成不等径的圆球,并彼此相切,离子键的键长是相邻阴阳离子的半径之和(如图)。已知a为常数,请计算下列问题:


(1)每个晶胞中平均分摊________个Na+,________个Cl-;
(2)若某NaCl晶体的质量为5.85g,它约含________mol NaCl晶胞;
(3)NaCl晶体离子键的键长为________,Na+离子半径与Cl-离子半径之比为![]() ________;
________;
(4)NaCl晶体不存在分子,但在高温下(大于等于1413℃时)晶体转变成气体NaCl的分子形式存在,现有1mol NaCl晶体,加强热使其气化,测得气体体积为11.2L(已折为标准状况)。则此时氯化钠气体的分子式为________。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
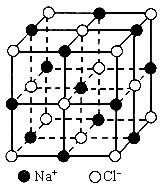

(1)每个晶胞中平均分摊________个Na+,________个Cl-;
(2)若某NaCl晶体的质量为5.85g,它约含________mol NaCl晶胞;
(3)NaCl晶体离子键的键长为________,Na+离子半径与Cl-离子半径之比为![]() ________;
________;
(4)NaCl晶体不存在分子,但在高温下(大于等于1413℃时)晶体转变成气体NaCl的分子形式存在,现有1mol NaCl晶体,加强热使其气化,测得气体体积为11.2L(已折为标准状况)。则此时氯化钠气体的分子式为________。
查看答案和解析>>
科目:高中化学 来源:知识精讲与能力训练 高三化学 题型:022
晶胞里晶体中最小重复单位,并在空间不断伸展构成晶体.NaCl晶体是一个正六面体(图参照例题).我们把阴、阳离子看成不等径的圆球,并彼此相切,离子键的键长是相邻阴阳离子的半径之和(如图).已知a为常数,请计算下列问题:

(1)每个晶胞中平均分摊________个Na+,________个Cl-.
(2)若某NaCl晶体的质量为5.85克,它约含________摩尔NaCl晶胞.
(3)NaCl晶体离子键的键长为________,Na+离子半径与Cl-离子半径之比为![]() =________.
=________.
(4)NaCl晶体不存在分子,但在高温下(≥1413℃时)晶体转变成气体NaCl的分子形式存在,现有1mol NaCl晶体,加强热使其气化,测得气体体积为11.2升(已折为标况).则此时氯化钠气体的分子式为________.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com