
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中氧化产物和还原产物的物质的量之比是1:2 | |
| C. | 反应中每生成5.7gAlON同时生成1.12LCO | |
| D. | AlON和CO的化学键类型不同 |
分析 Al2O3+C+N2$\frac{\underline{\;\;△\;\;}}{\;}$2AlON+CO中,N元素化合价降低,N2为氧化剂,C元素化合价升高,C为氧化剂,结合元素化合价的变化判断电子转移的数目.
解答 解:A.由化合价代数和为0可知,氮氧化铝中铝元素化合价为+3价,O为-2价,氮元素的化合价为-1,故A错误;
B.CO为氧化产物,AlON为还原产物,由反应可知物质的量比为1:2,故B正确;
C.状况未知,不能计算生成CO的体积,故C错误;
D.AlON属于原子晶体,含有共价键,Al2O3为离子化合物,含有离子键,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题

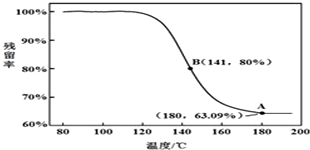
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
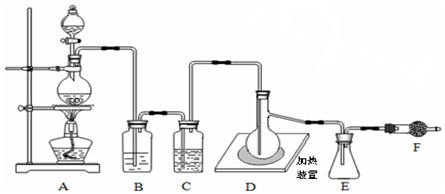
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 该反应为吸热反应 | |
| B. | 该反应的化学平衡常数表达式为K=$\frac{c(C)•c(D)}{c(A)•c(B)}$ | |
| C. | 其他条件不变时,增大体系的压强,化学平衡常数减小 | |
| D. | 单位时间内生成B和D的物质的量相等时,该反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(A)/(mol•L-1) | 6.00 | 3.50 | 3.00 | 3.00 |
| A. | 500s内A的分解速率为3.0×10-3 mol•L-1•s-1 | |
| B. | 1000s时A的转化率为50%,T1温度下的平衡常数为K1=0.75 | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1>K2,则T1>T2 | |
| D. | 平衡时,其他条件不变,再加入一定量的A,达新平衡后K值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
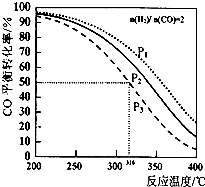 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com