
| 13 |
| 2 |
| m |
| M |
| 1g |
| 32g/mol |
| 1 |
| 32 |
| 44.6KJ | ||
|
| 13 |
| 2 |
| 13 |
| 2 |


科目:高中化学 来源: 题型:
| A、MnO4-、K+、Na+、SO42- |
| B、K+、H+、CO32-、Cl- |
| C、Mg2+、NH4+、Cl-、NO3- |
| D、Ba2+、K+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共用电子对偏移程度:H-Cl>H-Br |
| B、酸性:HClO4>HBrO4 |
| C、热稳定性:HCl>HBr |
| D、酸性:HCl<HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A2B溶液的体积(mL) | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| CD2溶液的体积(mL) | 0 | 20 | 40 | 60 | 70 | 80 | 120 |
| 沉淀质量(g) | 0 | 0.464 | 1.395 | 1.404 | 1.397 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO).一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO).一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子其物质的量(mol)与反应时间t(min)的关系曲线.下列说法错误的是( )| A、工业制取漂白液的化学反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O |
| B、a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+) |
| C、t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-=2Cl-+ClO3- |
| D、使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4、BaCO3都难溶于水,在医学上均可用作“钡餐” |
| B、用浸泡过高锰酸钾溶液的硅藻土保护水源 |
| C、明矾水解时产生具有吸附性的胶体粒子,可用作漂白粉 |
| D、棉花、蛋白质和油脂都是高分子化合物,水解产物均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
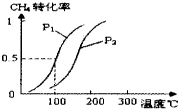 甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.
甲醇被称为2l世纪的新型燃料,请解决甲醇的有关问题.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | ||
| 1 | 150 |
| 0.1 | ||
| 2 |
| 5 | |||
| 3 | 350 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com