
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水淡化的方法有蒸馏法、________________________(填1种方法)。
(2)海水中制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为____。
(3)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
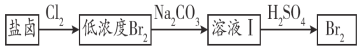
将Br2与Na2CO3反应的化学方程式补充完整:
___Br2+___Na2CO3===___NaBrO3+___ ________+___ ________
(4)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
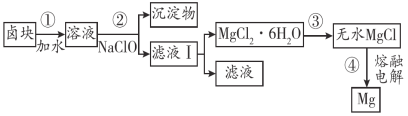
已知:常温下0.010 mol·L-1金属离子在不同pH下的沉淀情况如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是_____________。
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质。除去0.2 mol CO(NH2)2时消耗NaClO ________g。
【答案】电渗析法(或离子交换法) Cl-+H2O![]() ClO-+H2↑ 3 3 1 5 NaBr 3 CO2↑ 除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去 44.7
ClO-+H2↑ 3 3 1 5 NaBr 3 CO2↑ 除去溶液中含有的Fe2+、Fe3+、Mn2+杂质,使之完全生成沉淀而除去 44.7
【解析】
(1)海水淡化的方法主要有蒸馏法、电渗析发和离子交换法;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,根据化合价升降守恒配平方程式;
(4)盐卤加水溶解,加NaClO将Fe2+氧化为Fe3+,然后加入NaOH调节溶液的pH为9.8,使Fe2+、Fe3+、Mn2+转化为沉淀,过滤后,滤液经过蒸发浓缩,冷却结晶,过滤可得到氯化镁的晶体,在HCl氛围中加热可得到无水氯化镁,电解熔融的氯化镁的可制取单质镁,以此解答。
(1)海水淡化的方法主要有蒸馏法、电渗析发和离子交换法;
(2)电解饱和食盐水生成氢氧化钠、氯气和氢气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl-+H2O![]() ClO-+H2↑;
ClO-+H2↑;
(3)Br2与Na2CO3反应生成NaBrO3、NaBr和CO2,根据化合价升降守恒配平后反应的方程式为:3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(4)①步骤②中加入NaOH调节溶液的pH为9.8,可使除Mg2+以外的所有金属离子均成为沉淀,以便过滤除去;
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质,反应的方程式为:3NaClO+ CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O,因此除去0.2 mol CO(NH2)2时消耗NaClO的物质的量为0.6mol,其质量为0.6mol×74.5g/mol=44.7g。


科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)===2H2O(l) ΔH=-570.0 kJ·mol-1;②CO(g)+![]() O2(g)===CO2(g) ΔH=-280 kJ·mol-1。某H2和CO的混合气体完全燃烧放出141 kJ热量,同时消耗标准状况下5.6 L O2,则原混合气体中H2和CO的物质的量之比为( )
O2(g)===CO2(g) ΔH=-280 kJ·mol-1。某H2和CO的混合气体完全燃烧放出141 kJ热量,同时消耗标准状况下5.6 L O2,则原混合气体中H2和CO的物质的量之比为( )
A.2∶1B.1∶2C.1∶1D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示操作能实现实验目的的是( )

A. 用图甲装置分离碘和四氯化碳,在锥形瓶中收集到碘单质
B. 用图乙装置收集NO气体
C. 用图丙装置验证牺牲阳极的阴极保护法
D. 用图丁装置测定待测液中I2的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,某学习小组为了探究二氧化硫的某些性质,进行了如下实验。
Ⅰ.如图所示,使用试剂和装置探究二氧化硫的还原性:

(1)装置C的名称为________。
(2)装置B中溶液的现象为_______。
(3)学生甲预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。学生乙经过查阅资料发现少量白色沉淀可能是硫酸钡,因为装置或溶液中少量的氧气参与了氧化反应,请写出装置D中反应的化学方程式:______________。
Ⅱ.经过思考,设计了如下装置,且所配制的溶液均使用无氧蒸馏水,检验SO2 在无氧干扰时,是否与氯化钡反应生成沉淀。

(4)加入碳酸钠粉末的目的是________。
(5)当_____时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(6)裝置中选用澄清石灰水而不用氢氧化钠溶液的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
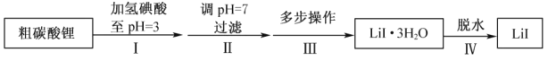
【题目】碘化锂(![]() )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备![]() 和
和![]() ,流程如下:
,流程如下:
已知:![]() 在75~80℃转变成
在75~80℃转变成![]() ,80~120℃转变成
,80~120℃转变成![]() ,300℃以上转变成无水
,300℃以上转变成无水![]() 。
。
b.![]() 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c.![]() 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
(1)步骤II,调![]() ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的![]() 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得![]() 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得![]() 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得![]() 、
、![]() 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调![]() ,用滴定管中的
,用滴定管中的![]() 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的![]() 标准溶液体积计算,得
标准溶液体积计算,得![]() 、
、![]() 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。![]() 纯度偏低。
纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③![]() 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。
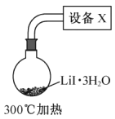
(4)步骤IV,采用改进的实验方案(装置如图),可以提高![]() 纯度。
纯度。
①设备X的名称是________。
②请说明采用该方案可以提高![]() 纯度的理由________。
纯度的理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用系统命名法给下列有机物命名:
CH3CH2C(CH3)2CH2CH3_________________________________________
化合物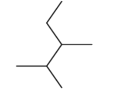 按系统命名法命名__________________________
按系统命名法命名__________________________
2,3-二甲基-4-乙基-2-庚烯的结构简式__________________________
(2)分子式为C4H8O2能发生水解反应的同分异构体有_____种,甲苯的一氯代物有______种。
(3)从某些植物树叶提取的挥发油中含有下列主要成分

A的分子式是___________,B中的含氧官能团是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CO2转化为甲醇的原理为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C. 500 ℃时该反应的平衡常数K=3
D. 平衡时H2 的转化率为75%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
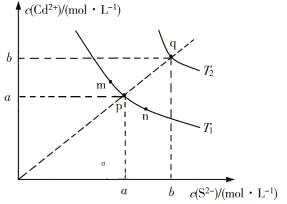
A. 图中a和b分别为T1、T2温度下CdS在水中的溶解度
B. 图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C. 向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D. 温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com