
【题目】25℃,用0.1000mol/L的NaOH溶液滴定40.00mL0.1mol/L的某二元弱酸H2R溶液,所得滴定曲线如图所示(设所得溶液体积等于两种溶液体积之和)。下列说法正确的是
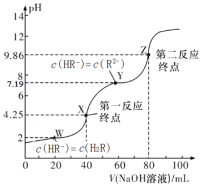
A.若只滴定到第一反应终点,可用酚酞做指示剂
B.图中Y点对应的溶液中:c(Na+)+c(H+)=2c(HR-)+c(OH-)
C.图中Z点对应的溶液中c(Na+)约为0.067mol/L,R2-的水解率大于1%
D.若pK=-lgK,2HR-![]() R2-+H2R达平衡时pK=5.19
R2-+H2R达平衡时pK=5.19
【答案】D
【解析】
NaOH与H2R以物质的量为1:1反应时,即40.00mLNaOH溶液,生成NaHR和H2O,此时溶质为NaHR;
NaOH与H2R以物质的量为2:1反应时,即80.00mLNaOH溶液,生成Na2R和H2O,此时溶质为Na2R。
A.结合图像可知,第一终点时,溶液呈酸性,应用甲基橙作指示剂,不可用酚酞做指示剂,A错误;
B.溶液中存在电荷守恒:c(Na+)+c(H+)=c(HR-)+2c(R2-)+c(OH-),Y点,c(HR-) =c(R2-),则c(Na+)+c(H+)=3c(HR-)+c(OH-),B错误;
C.Z点,溶质为Na2R,溶液体积大约变为H2R溶液体积的3倍,则Na2R的浓度约为起始浓度的三分之一,即0.1000mol/L×![]() ≈0.033mol/L,Na+浓度为Na2R浓度的两倍,即0.067mol/L,R2-+H2O
≈0.033mol/L,Na+浓度为Na2R浓度的两倍,即0.067mol/L,R2-+H2O![]() HR-+OH-,pH=9.86,则c(H+)=10-9.86,c(OH-)=
HR-+OH-,pH=9.86,则c(H+)=10-9.86,c(OH-)=![]() ,R2-的浓度约等于Na2R的浓度,故水解率≈
,R2-的浓度约等于Na2R的浓度,故水解率≈![]() =(3.30×10-1.14)%<1%,C错误;
=(3.30×10-1.14)%<1%,C错误;
D.H2R![]() H++HR-,Ka1=
H++HR-,Ka1=![]() ,由图可知,c(HR-)=c(H2R)时,pH=2,即c(H+)=10-2,则Ka1=10-2,HR-
,由图可知,c(HR-)=c(H2R)时,pH=2,即c(H+)=10-2,则Ka1=10-2,HR-![]() H++R2-,Ka2=
H++R2-,Ka2=![]() ,由图可知,c(HR-)=c(R2-)时,pH=7.19,即c(H+)=10-7.19,则Ka2=10-7.19,2HR-
,由图可知,c(HR-)=c(R2-)时,pH=7.19,即c(H+)=10-7.19,则Ka2=10-7.19,2HR-![]() R2-+H2R的K=
R2-+H2R的K=![]() =
=![]() ×
×![]() =
=![]() =
=![]() =
=![]() ,故pK=-lg(10-5.19)=5.19,D正确。
,故pK=-lg(10-5.19)=5.19,D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中的浓硫酸滴入②中,预测的现象与结论相符的是( )

A. 若②为浓盐酸;产生大量气体产生;说明硫酸的酸性比盐酸强
B. 若②为铜片;有气泡产生,底部生成灰白色固体;说明浓硫酸有强氧化性
C. 若②为蓝色硫酸铜晶体;蓝色晶体变为白色;说明浓硫酸有吸水性,发生物理变化
D. 若②为蔗糖;白色固体变为黑色海绵状,有气体放出;说明浓硫酸有脱水性、氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠投入到滴有紫色石蕊试液的盛冷水的烧杯中,甲同学认为可观察到下列现象,其中正确的有( )
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生
③反应后溶液变红
④钠熔成闪亮的小球
⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是

A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:

已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:___________。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是___________。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________。
(4)装置B中生成NaClO2的化学方程式是____。
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.___;b._____;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为______。
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为_____。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是工农业生产中重要的基础物质,研究合成氨及氨的应用具有重要意义。
(1)已知:N2(g)+3H2(g)=2NH3(g)ΔH=-92kJ/mol,N2(g)+3H2(g)![]() 2NH3(g)的活化能为508kJ/mol。则2NH3(g)
2NH3(g)的活化能为508kJ/mol。则2NH3(g)![]() N2(g)+3H2(g)的活化能为___________kJ/mol
N2(g)+3H2(g)的活化能为___________kJ/mol
(2)我国科研人员研制出Ti-H-Fe双温区催化剂(Ti-H区与Fe区温差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如下图一,其中吸附在催化剂表面的物种用“*”标注。
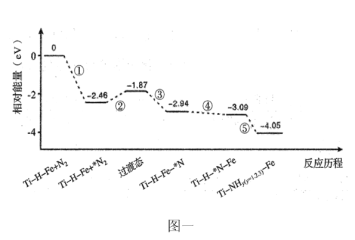
下列说法中正确的是___________。
A.①为![]() 的断裂过程
的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂时合成氨反应转变为吸热反应
(3)以氨和CO2为原料合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)。工业生产时,需要原料气带有水蒸气,图二中曲线Ⅰ、Ⅱ、Ⅲ表示在不同水碳比[
CO(NH2)2(l)+H2O(g)。工业生产时,需要原料气带有水蒸气,图二中曲线Ⅰ、Ⅱ、Ⅲ表示在不同水碳比[![]() ]时,CO2的平衡转化率与氨碳比[
]时,CO2的平衡转化率与氨碳比[![]() ]之间的关系。
]之间的关系。
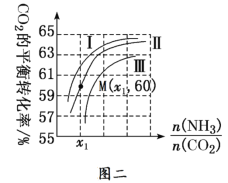
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是________,判断依据是________。
②测得M点氨气的平衡转化率为40%,则x1=______。
(4)将氨氧化法制硝酸过程中氨经催化氧化后的气体(高于800℃)急剧冷却到100℃以下,一方面除去大量的H2O,使NO(g)和O2(g)发生反应,另一方面温度低有利于生成NO2(g)。
2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g)![]() N2O2(g)(反应快,瞬间达到平衡)ΔH1<0
N2O2(g)(反应快,瞬间达到平衡)ΔH1<0
v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g)![]() 2NO2(g)(反应慢)ΔH2<0
2NO2(g)(反应慢)ΔH2<0
v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
其中k1、k2是速率常数,随温度上升而增大。
则:①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_____,根据速率方程分析,升高温度该总反应速率减小的原因是__________。
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=_____,根据速率方程分析,升高温度该总反应速率减小的原因是__________。
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则可能变为相应的点为__(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列有关叙述正确的是( )
①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N—H键数目为0.2NA
④常温下1L 0.5mol/L NH4Cl溶液与2L 0.25mol/L NH4Cl溶液所含NH4+的数目相同
⑤常温下4.6gNO2和N2O4混合气体中所含原子总数为3NA
⑥等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3:1
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
A. ①④⑦ B. ②⑤⑧ C. ②③④⑥ D. ①②④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
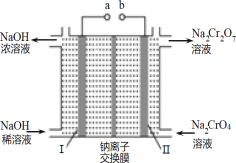
【题目】利用含铬废料(主要含 Cr2O3,还含有 FeO、SiO2、Al2O3 等杂质)制备重铬酸钠,实现清洁化工生产,工艺流程如图:
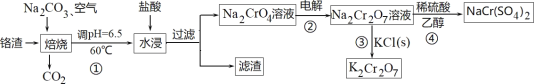
回答下列问题:
(1)焙烧 Cr2O3 转化为Na2CrO4 的化学反应方程式是_____;
(2)实验室模拟此工业流程①,控制反应温度 60℃的方法是_____;
(3)流程②用石墨做电极电解 Na2CrO4 溶液,制备Na2Cr2O7,其原理如图所示,a 是_____极;电极Ⅱ的电极反应式是_____;当生成 2mol Na2Cr2O7时,电路中转移的电子_____mol;
(4)由下图和下表中的溶解度变化,流程③制备 K2Cr2O7,应先充分加热,然后_____反应才能顺利进行;

重铬酸钠的溶解度表:
温度℃ | 10 | 20 | 40 | 60 | 80 | 100 |
溶解度% | 61.6 | 62.8 | 65.1 | 71.8 | 78.7 | 81.1 |
(5)为进一步减少制得的 K2Cr2O7 晶体中 NaCl 等杂质,应再进行_____操作;
(6)流程④Na2Cr2O7 溶液与乙醇反应,乙醇可能被氧化为_____(写一种即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com