
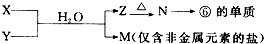
 ,故答案为:
,故答案为: ;
;
| ||
| ||


科目:高中化学 来源: 题型:
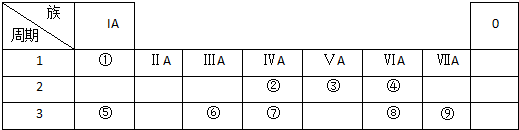
| A、①③⑤ | B、②⑤ |
| C、②③⑤ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
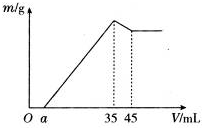
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量的氨水Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、用氨水吸收过量的二氧化硫NH3?H2O+SO2═NH4++HSO3- |
| C、向偏铝酸钠溶液中加入过量稀盐酸水AlO2-+H++H2O═Al(OH)3↓ |
| D、次氯酸钙溶液中通入过量的二氧化碳ClO-+CO2+H2O═HCO3-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
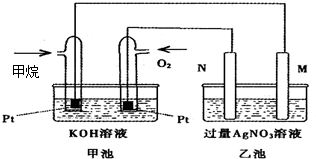 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

 的合成路线如图2:[( )内为反应类型,
的合成路线如图2:[( )内为反应类型, 内为目标产物]
内为目标产物] 内物质的结构简式:Ⅰ
内物质的结构简式:Ⅰ查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
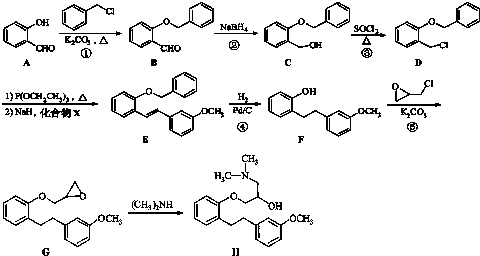
 .化合物
.化合物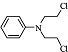 是合成抗癌药物美发伦的中间体,现以
是合成抗癌药物美发伦的中间体,现以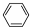 和
和 为原料制备该化合物的合成路线流程图如下,请在空白处填写相应的有机物的结构简式.
为原料制备该化合物的合成路线流程图如下,请在空白处填写相应的有机物的结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:
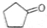 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成:
| 反应1 |
| 反应2 |
| 反应3 |
 ,则下列说法错误的是( )
,则下列说法错误的是( )| A、反应1可用的试剂是氯气 |
| B、反应1为取代反应,反应2为消去反应 |
| C、反应3可用的试剂是氧气和铜 |
| D、1molA完全燃烧消耗6mol氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com