

 .
.
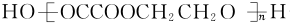 +(2n-1)H2O.
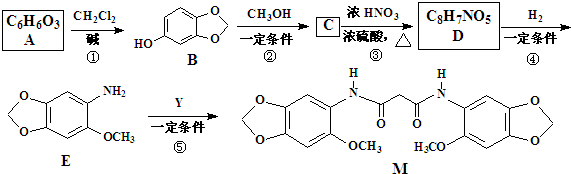
+(2n-1)H2O. 分析 由信息(Ⅰ)及反应①可推知A为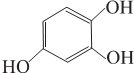 ,反应③是引入-NO2的反应,由信息(Ⅱ)可知反应④是-NO2被还原成-NH2的反应,E中的-OCH3应是反应②生成的,所以C是
,反应③是引入-NO2的反应,由信息(Ⅱ)可知反应④是-NO2被还原成-NH2的反应,E中的-OCH3应是反应②生成的,所以C是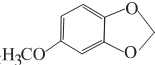 ,D为
,D为 .
.
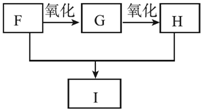
(4)M在酸性条件下水解生成的物质N应该是HOOCCH2COOH,其同系物中含碳量最低的是HOOCCOOH,根据信息,F为乙二醇,G为乙二醛,I为一种六元环状化合物,则I为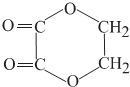 .
.
解答 解:由信息(Ⅰ)及反应①可推知A为 ,反应③是引入-NO2的反应,由信息(Ⅱ)可知反应④是-NO2被还原成-NH2的反应,E中的-OCH3应是反应②生成的,所以C是
,反应③是引入-NO2的反应,由信息(Ⅱ)可知反应④是-NO2被还原成-NH2的反应,E中的-OCH3应是反应②生成的,所以C是 ,D为
,D为 .
.
(1)除反应④是还原反应外,其余反应都是取代反应,
故答案为:取代反应;还原反应;
(2)若先硝化,B中酚羟基容易被硝酸氧化,使M产率降低,所以反应②③位置不能调换,
故答案为:否,若先硝化,B中酚羟基容易被硝酸氧化,使M产率降低;
(3)B中官能团为(酚)羟基和醚键,
故答案为:(酚)羟基和醚键;
(4)M在酸性条件下水解生成的物质N应该是HOOCCH2COOH,其同系物中含碳量最低的是HOOCCOOH,根据信息,F为乙二醇,G为乙二醛,I为一种六元环状化合物,则I为 .F和H反应生成I的化学方程式:
.F和H反应生成I的化学方程式: ,
,
故答案为:HOOCCH2COOH; ;
;
(5)F和H发生缩聚反应生成一种高分子化合物,该反应的化学方程式:nHOOCCOOH+nHOCH2CH2OH$?_{△}^{浓硫酸}$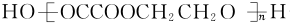 +(2n-1)H2O,
+(2n-1)H2O,
故答案为:nHOOCCOOH+nHOCH2CH2OH$?_{△}^{浓硫酸}$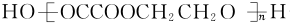 +(2n-1)H2O.
+(2n-1)H2O.
点评 本题考查有机物的推断、化学反应类型、官能团、同分异构体的书写、化工生产条件的控制等,注意根据有机物的结构与分子式进行分析解答,侧重考查学生的分析推理能力、知识迁移运用能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 实验室以2一丁醇(
实验室以2一丁醇( )为原料制备2-氯丁烷
)为原料制备2-氯丁烷 ),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:
),实验装置如图所示(夹持、加热装置省去未画)相关数据见下表:| 物质 | 熔点 (℃) | 沸点(℃) |
| 2-丁醇 | -114.7 | 99.5 |
| 2-氯乙烷 | -131.3 | 68.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
某化学学习小组发现在碱性溶液中,NO2会发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.05×10-4mol/L | B. | 5.26×10-4mol/L | C. | 5.05×10-3mol/L | D. | 5.26×10-3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 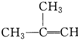 -CH3+Br2→ -CH3+Br2→ | |
| B. | CH2=CH-CH3+HCl→ | |
| C. | CH2=CH-CH=CH2+Br2→ | |
| D. | CH3-CH=CH2+H2O$→_{加热、加压}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分子中至少有9个碳原子处于同一平面上 分子中至少有9个碳原子处于同一平面上 | |
| B. |  的核磁共振氢谱有5个峰 的核磁共振氢谱有5个峰 | |
| C. | 某烯烃与氢气加成后得到2,2-二甲基丁烷,该烯烃的名称是3,3-二甲基-1-丁烯 | |
| D. | 能够测定分子化学键的方法是核磁共振谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+不能与SCN-形成血红色化合物 | B. | 该晶体中一定含有SCN- | ||
| C. | Fe3+的氧化性比氯气的氧化性强 | D. | Fe2+被氯气氧化成Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com