
| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 加热才能发生的反应一定是吸热反应 | |
| B. | 断开化学键的过程会吸收能量 | |
| C. | 化学能不仅可以与热能相互转化,还可以与电能相互转化 | |
| D. | 燃烧可能为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
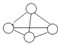 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1mol/LKSCN溶液 ②另取适量A溶液,滴加少量0.01mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入下图所示装置 | 甲中紫色褪去,乙中不褪色,试管中收集到气体 | 含有两种气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 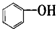 属于醇类化合物 属于醇类化合物 | B. | 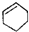 属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH3CH(CH3)2属于链状化合物 | D. | 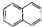 属于脂环化合物 属于脂环化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com