
”¾ĢāÄæ”æŃŠ¾æ·¢ĻÖNOxŗĶSO2ŹĒĪķö²µÄÖ÷ŅŖ³É·Ö”£
I£®NOxÖ÷ŅŖĄ“Ō“ÓŚĘū³µĪ²Ęų£¬æÉŅŌĄūÓĆ»Æѧ·½·Ø½«¶žÕß×Ŗ»ÆĪŖĪŽ¶¾ĪŽŗ¦µÄĪļÖŹ”£
ŅŃÖŖ£ŗN2(g)+O2(g)![]() 2NO(g) ”÷H=+180 kJ”¤ mol£1
2NO(g) ”÷H=+180 kJ”¤ mol£1
2CO(g)+O2(g)![]() 2CO2(g) ”÷H=£564 kJ”¤ mol£1
2CO2(g) ”÷H=£564 kJ”¤ mol£1
(1)2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ”÷H=___________£¬øĆ·“Ó¦ŌŚ___________ĻĀÄÜ×Ō·¢½ųŠŠ(Ģī”°øßĪĀ”±µĶĪĀ”±»ņ”°ČĪŅāĪĀ¶Č”±)
2CO2(g)+N2(g) ”÷H=___________£¬øĆ·“Ó¦ŌŚ___________ĻĀÄÜ×Ō·¢½ųŠŠ(Ģī”°øßĪĀ”±µĶĪĀ”±»ņ”°ČĪŅāĪĀ¶Č”±)
(2)T”ꏱ£¬½«µČĪļÖŹµÄĮæµÄNOŗĶCO³äČėČŻ»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ£¬±£³ÖĪĀ¶ČŗĶĢå»ż²»±ä£¬·“Ó¦¹ż³Ģ0£5minÖŠNOµÄĪļÖŹµÄĮæĖꏱ¼ä±ä»ÆČēÓŅĶ¼ĖłŹ¾”£

¢ŁŅŃÖŖ£ŗĘ½ŗāŹ±ĘųĢåµÄ·ÖŃ¹=ĘųĢåµÄĢå»ż·ÖŹż”ĮĢåĻµµÄ×ÜŃ¹Ē棬T”ꏱ“ļµ½Ę½ŗā£¬“ĖŹ±ĢåĻµµÄ×ÜŃ¹ĒæĪŖ£Š=14MPa£¬ŌņT”ꏱøĆ·“Ó¦µÄŃ¹Į¦Ę½ŗā³£ŹżKp=___________MPa£1£»Ę½ŗāŗó£¬ŌŁĻņČŻĘ÷ÖŠ³äČėNOŗĶCO2ø÷0.1mol£¬Ę½ŗā½«___________(Ģī”°Ļņ×ó”±”°ĻņÓŅ”±»ņ”°²»")ŅʶÆ
¢Ś15minŹ±£¬ČōøıäĶā½ē·“Ó¦Ģõ¼ž£¬µ¼ÖĀn(NO)·¢ÉśČēĶ¼ĖłŹ¾µÄ±ä»Æ£¬ŌņøıäµÄĢõ¼žæÉÄÜŹĒ___________(Ģī×ÖÄø)
A£®ÉżĪĀ B£®Ōö“óCOÅØ¶Č C£®¼ÓČė“߻ƼĮ D¼õŠ”ČŻĘ÷Ģå»ż
¢ņ£®SO2Ö÷ŅŖĄ“Ō“ÓŚĆŗµÄČ¼ÉÕ”£Č¼ÉÕŃĢĘųµÄĶŃĮņ¼õÅÅŹĒ¼õÉŁ“óĘųÖŠŗ¬Įņ»ÆŗĻĪļĪŪČ¾µÄ¹Ų¼ü”£
(1)ŅŃÖŖ£ŗŃĒĮņĖįµÄµēĄė³£ŹżĪŖKa1=2.0”Į10£2£¬Ka2=6.0”Į10£7”£ŌņNaSO3ČÜŅŗ³Ź___________(Ģī”°ĖįŠŌ”±”¢”°ÖŠŠŌ”±»ņ”°¼īŠŌ”±)
(2)ČēĶ¼ĖłŹ¾µÄµē½ā×°ÖĆ£¬æɽ«Īķö²ÖŠµÄNO”¢SO2×Ŗ»ÆĪŖĮņĖįļ§£¬“Ó¶ųŹµĻÖ·ĻĘųµÄ»ŲŹÕŌŁĄūÓĆ”£ĶØČėNOµÄµē¼«·“Ó¦Ź½ĪŖ___________£»ČōĶØČėµÄNĢå»żĪŖ4.48L(±źæöĻĀ)£¬ŌņĮķĶāŅ»øöµē¼«ĶØČėSO2µÄÖŹĮæĄķĀŪÉĻÓ¦ĪŖ__________g”£

”¾“š°ø”æ£744 kJ”¤mol£1 µĶĪĀ 0.125(»ņ1/8) ²» BD ĖįŠŌ 6H£«£«NO£«5e£===NH4+£«H2O 32
”¾½āĪö”æ
øł¾ŻøĒĖ¹¶ØĀÉŗĶ”÷G=”÷HT”÷S<0½ā“š£»øł¾ŻČż¶ĪŹ½, »ÆŃ§Ę½ŗā³£ŹżK ÓėQcµÄ¹ŲĻµ½ųŠŠÅŠ¶Ļ£»øł¾Ż 15minŹ±,øıäijŅ»ŅņĖŲ,NOµÄĪļÖŹµÄĮæ¼õÉŁ,ĖµĆ÷Ę½ŗāĻņÕż·“Ó¦·½ĻņŅʶÆ,½įŗĻ»ÆŃ§Ę½ŗāµÄÓ°ĻģŅņĖŲ·ÖĪö£»øł¾ŻHSO3µÄµēĄėĘ½ŗā³£ŹżÓėĖ®½āĘ½ŗā³£Źż“óŠ”ÅŠ¶Ļ£»øł¾Żµē½ā×°ÖƵƏ§µē×ÓŹżÄæŹŲŗć½ųŠŠ¼ĘĖć”£
£Ø1£©øł¾ŻøĒĖ¹¶ØĀÉ¢ŁN2(g)+O2(g)![]() 2NO(g) ”÷H=+180 kJ”¤ mol£1 ¢Ś2CO(g)+O2(g)
2NO(g) ”÷H=+180 kJ”¤ mol£1 ¢Ś2CO(g)+O2(g)![]() 2CO2(g) ”÷H=£564 kJ”¤ mol£1,¢Ś¢ŁµĆ£ŗ2NO(g)+2CO(g)
2CO2(g) ”÷H=£564 kJ”¤ mol£1,¢Ś¢ŁµĆ£ŗ2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ”÷H= (564180)kJmol1=744kJmol1£¬øĆ·“Ó¦ĪŖĘųĢåĢå»żĖõŠ”µÄ·ÅČČ·“Ó¦£¬Ęä”÷H<0”¢”÷S<0£¬ŌņĪĀ¶Č“¦ÓŚµĶĪĀĻĀĀś×ć”÷G=”÷HT”÷S<0£¬ÄÜ×Ō·¢½ųŠŠ£»¹Ź“š°øĪŖ£ŗ744kJmol1£»µĶĪĀ£»
2CO2(g)+N2(g) ”÷H= (564180)kJmol1=744kJmol1£¬øĆ·“Ó¦ĪŖĘųĢåĢå»żĖõŠ”µÄ·ÅČČ·“Ó¦£¬Ęä”÷H<0”¢”÷S<0£¬ŌņĪĀ¶Č“¦ÓŚµĶĪĀĻĀĀś×ć”÷G=”÷HT”÷S<0£¬ÄÜ×Ō·¢½ųŠŠ£»¹Ź“š°øĪŖ£ŗ744kJmol1£»µĶĪĀ£»
(2)¢ŁÓÉĶ¼1ÖŖ,2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)£¬
2CO2(g)+N2(g)£¬
ĘšŹ¼(mol) 0.4 0.4 0 0
×Ŗ»Æ(mol) 0.2 0.2 0.2 0.1
Ę½ŗā(mol) 0.2 0.2 0.2 0.1
ø÷×é·ÖµÄĢå»ż·ÖŹż·Ö±šŹĒ£ŗ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
”¢![]() £¬,Kp=
£¬,Kp=![]() =(14”Į
=(14”Į![]() )2”Į(14
)2”Į(14![]() )/ [(14”Į
)/ [(14”Į![]() )2”Į(14”Į
)2”Į(14”Į![]() )2]=0.125£»øł¾Ż¢ŁµÄ·ÖĪö,»ÆŃ§Ę½ŗā³£ŹżK=
)2]=0.125£»øł¾Ż¢ŁµÄ·ÖĪö,»ÆŃ§Ę½ŗā³£ŹżK=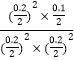 =5,ŌŁĻņČŻĘ÷ÖŠ³äČėNOŗĶCO2ø÷0.3mol£¬“ĖŹ±µÄÅضČÉĢQc=
=5,ŌŁĻņČŻĘ÷ÖŠ³äČėNOŗĶCO2ø÷0.3mol£¬“ĖŹ±µÄÅضČÉĢQc=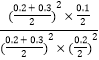 =5=K£¬Ņņ“ĖĘ½ŗā²»ŅĘ¶Æ£»¹Ź“š°øĪŖ£ŗ0.125£»²»£»
=5=K£¬Ņņ“ĖĘ½ŗā²»ŅĘ¶Æ£»¹Ź“š°øĪŖ£ŗ0.125£»²»£»
¢Ś15minŹ±£¬øıäijŅ»ŅņĖŲ£¬NOµÄĪļÖŹµÄĮæ¼õÉŁ£¬ĖµĆ÷Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£ŗ
A. Õż·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬ÉżĪĀ£¬Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄĪļÖŹµÄĮæŌö“󣬹ŹA“ķĪó£»
B. Ōö“óCOµÄÅØ¶Č£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬NOµÄĪļÖŹµÄĮæ¼õŠ”£¬¹ŹBÕżČ·£»
C. ¼ÓČė“߻ƼĮ£¬»ÆŃ§Ę½ŗā²»ŅĘ¶Æ£¬¹ŹC“ķĪó£»
D. ¼õŠ”ČŻĘ÷µÄĢå»ż£¬Ļąµ±ÓŚŌö“óŃ¹Ēæ£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ£¬NOĪļÖŹµÄĮæ¼õŠ”£¬¹ŹDÕżČ·£»
¹Ź“š°øĪŖ£ŗBD£»
¢ņ(1)ÓÉÓŚHSO3µÄĖ®½ā³£ŹżK=Kw/Ka1=5.0”Į1013<Ka2=6.0”Į107,ĖµĆ÷HSO3µÄµēĄėĘ½ŗā³£Źż“óÓŚĖ®½āĘ½ŗā³£Źż£¬ŌņHSO3µÄČÜŅŗĻŌĖįŠŌ£»“š°ø£ŗĖįŠŌ£»
(2)øł¾Żµē½ā×°ÖĆ£¬NOŗĶSO2×Ŗ»ÆĪŖĮņĖįļ§£¬ĖµĆ÷NO×Ŗ»Æ³ÉNH4+£¬¼“NOŌŚŅõ¼«ÉĻ·¢Éś·“Ó¦NO+6H++5e=NH4++H2O£¬Ńō¼«·“Ó¦Ź½ĪŖSO2+2H2O2e=4H++SO42,øł¾ŻµĆŹ§µē×ÓŹżÄæŹŲŗć£¬ÓŠ2NO10e5SO2£¬ŌņSO2µÄĪļÖŹµÄĮæĪŖ£ŗn(SO2)=5/2n(NO)=4.48L/22.4Lmol-1”Į5/2=0.5mol£¬SO2µÄÖŹĮæĪŖ64g/mol”Į0.5mol=32g£¬¹Ź“š°øĪŖ£ŗ6H£«£«NO£«5e£===NH4+£«H2O£»32”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÉčNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ(””””)
A.ŌŚ³£ĪĀ³£Ń¹ĻĀ£¬48 gŃõĘųŗĶ³ōŃõµÄ»ģŗĻĘųĢåŗ¬ŃõŌ×ÓŹżŹĒ3NA
B.±ź×¼×“æöĻĀ£¬22.4 L H2OÖŠŗ¬ÓŠµÄŌ×ÓŹżÄæĪŖ3NA
C.Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬NAøöCO2ÓėNAøöN2ŗĶO2µÄ»ģŗĻĘųĢåµÄĢå»ż²»ĻąµČ
D.ĪļÖŹµÄĮæÅضČĪŖ0.5 mol”¤L£1µÄMgCl2ČÜŅŗÖŠ£¬ŗ¬ÓŠCl£ŹżĪŖNA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĢ½¾æĖįÓź¶ŌÖ²ĪļŅ¶Ę¬¹āŗĻ×÷ÓƵÄÓ°Ļģ£¬æĘŃŠŠ”×éŹ¹ÓĆijÖÖÖ²ĪļÓ×Ćē×÷ĪŖŹµŃé²ÄĮĻ£¬¶ŌĘä½ųŠŠÄ£ÄāĖįÓź“¦Ąķ£¬²æ·Ö½į¹ūČē±ķ1ŗĶĶ¼1£ŗ
×鱚 | Ä£ÄāĖįÓźÖµ | Ņ¶ĀĢĖŲa(mg/g) | Ņ¶ĀĢĖŲ b(mg/g) |
A | pH7£®0 | 2£®29 | 0£®94 |
B | pH4£®5 | 2£®32 | 0£®95 |
C | pH3£®5 | 2£®14 | 0£®86£® |
D | pH2£®5 | 1£®41 | 0£®73 |
±ķ1£ŗÄ£ÄāĖįÓź¶ŌijÖÖÖ²ĪļÓ×ĆēŅ¶Ę¬¹āŗĻÉ«ĖŲŗ¬ĮæµÄÓ°Ļģ

£Ø1£©ĀĢŅ¶ÖŠÉ«ĖŲµÄĢįČ”³£ÓĆ______×öČܼĮ£¬Ęä·ÖĄėŌņĄūÓĆĮĖ²»Ķ¬É«ĖŲŌŚÓŠ»śČܼĮÖŠ______²»Ķ¬µÄĢŲµć”£
£Ø2£©±¾ŹµŃéÖŠA×éµÄ×÷ÓĆŹĒ________£¬ĘäÓą×é±ŲŠėÓėA×é±£³ÖĻąĶ¬µÄ»·¾³ŅņĖŲÓŠ________(ŹŌ¾ŁĮ½Ļī)”£
£Ø3£©Ēė½įŗĻ±ķ1·ÖĪöĖįÓźÓ°ĻģÖ²Īļ¹āŗĻĖŁĀŹµÄŌŅņ£ŗ_________________________________”£
£Ø4£©øł¾ŻČÜŅŗ֊ijĪļÖŹ¶ŌŅ»¶Ø²Ø³¤¹āµÄĪüŹÕÖµÓėĘäÅØ¶Č³ÉÕż±ČµÄŌĄķ£¬æɶŌĢįČ”µÄÉ«ĖŲŗ¬Įæ½ųŠŠ²ā¶Ø”£ĻÖŅŖ²ā¶ØÉ«ĖŲĢįČ”ŅŗÖŠŅ¶ĀĢĖŲaµÄŗ¬Į棬ĖłŃ”¹āµÄ²Ø³¤ĪŖ665nm£¬¶ų²»ŹĒŅ¶ĀĢĖŲaĪüŹÕ¹āÄÜ°Ł·Ö±ČøüøßµÄ425nm£¬Ēėøł¾ŻĶ¼2·ÖĪöŌŅņ”£______________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĖ®ŃīĖįµÄ½į¹¹¼ņŹ½ĪŖ![]() £¬Ė®ŃīĖįõ„EĪŖ×ĻĶāĪüŹÕ¼Į£¬æÉÓĆÓŚÅäÖĘ·ĄÉ¹ĖŖ”£EµÄŅ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
£¬Ė®ŃīĖįõ„EĪŖ×ĻĶāĪüŹÕ¼Į£¬æÉÓĆÓŚÅäÖĘ·ĄÉ¹ĖŖ”£EµÄŅ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ£ŗ

ŅŃÖŖ£ŗ2RCH2CHO ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
”£»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©±„ŗĶŅ»ŌŖ“¼AÖŠŃõµÄÖŹĮæ·ÖŹżŌ¼ĪŖ21.6%£¬ŌņAµÄ·Ö×ÓŹ½ĪŖ________£»½į¹¹·ÖĪöĻŌŹ¾AÖ»ÓŠŅ»øö¼×»ł£¬AµÄĆū³ĘĪŖ_____”£
£Ø2£©µŚ¢Ū²½µÄ·“Ó¦ĄąŠĶĪŖ____£» DÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘĪŖ______£»
£Ø3£©µŚ¢Ł²½·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ______”£
£Ø4£©EµÄ·Ö×ÓŹ½ŹĒ______”£
£Ø5£©1molĖ®ŃīĖį·Ö±šĻūŗÄNaOH”¢NaHCO3µÄĪļÖŹµÄĮæÖ®±ČŹĒ______”£
£Ø6£©XŹĒ±ČĖ®ŃīĖį¶ąŅ»øöĢ¼Ō×ÓµÄĶ¬ĻµĪļ”£XµÄĶ¬·ÖŅģ¹¹ĢåÖŠ£¬·ūŗĻĻĀĮŠĢõ¼žµÄ¹²__ÖÖ£¬ĘäÖŠČ”“ś»łŌŚ±½»·µÄ¶ŌĪ»ĒŅÄÜĻūŗÄ3molNaOHµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ŹĒ_______”£¢Ł±½»·ÉĻÓŠĮ½øöČ”“ś»ł¢ŚÓėFeCl3·¢ÉśĻŌÉ«·“Ó¦¢ŪÄÜ·¢ÉśĖ®½ā·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼ģŃéijČÜŅŗÖŠŹĒ·ńŗ¬ÓŠ![]() £¬³£ÓƵķ½·ØŹĒ( )
£¬³£ÓƵķ½·ØŹĒ( )
A.Ȕѳ£¬µĪ¼ÓBaCl2ČÜŅŗ£¬æ“ŹĒ·ńÓŠ²»ČÜÓŚĖ®µÄ°×É«³ĮµķÉś³É
B.Ȕѳ£¬µĪ¼ÓĻ”ŃĪĖįĖį»ÆµÄBaCl2ČÜŅŗ£¬æ“ŹĒ·ńÓŠ²»ĀäÓŚĖ®µÄ°×É«³ĮµķÉś³É
C.Ȕѳ£¬µĪ¼ÓĻ”ĮņĖį£¬ŌŁµĪ¼ÓBaCl2ČÜŅŗ£¬æ“ŹĒ·ńÓŠ²»ĀäÓŚĖ®µÄ°×É«³ĮµķÉś³É
D.Ȕѳ£¬µĪ¼ÓĻ”ŃĪĖį£¬ĪŽĆ÷ĻŌĻÖĻó£¬ŌŁµĪ¼ÓBaCl2ĀäŅŗ£¬æ“ŹĒ·ńÓŠ²»ČÜÓŚĖ®µÄ°×É«³ĮµķÉś³É
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĀĮŌŖĖŲŌŚ×ŌČ»½ēÖŠÖ÷ŅŖ“ęŌŚÓŚĀĮĶĮæó£ØÖ÷ŅŖ³É·ÖĪŖAl2O3£¬»¹ŗ¬ÓŠFe2O3”¢FeO”¢SiO2£©ÖŠ”£¹¤ŅµÉĻÓĆĀĮĶĮæóÖʱøĀĮµÄijÖÖ»ÆŗĻĪļµÄ¹¤ŅÕĮ÷³ĢČēĻĀ”£

£Ø1£©ŌŚĀĖŅŗAÖŠ¼ÓČėĘÆ°×Ņŗ£¬ÄæµÄŹĒŃõ»Æ³żĢś£¬ĖłµĆĀĖŅŗBĻŌĖįŠŌ”£
¢ŁøĆ¹ż³ĢÖŠÉę¼°Ä³Ńõ»Æ»¹Ō·“Ó¦ČēĻĀ£¬ĒėĶź³É£ŗ__Fe2+___ClO£+£Ø £©___=____Fe£ØOH£©3”ż+__C1©+£Ø £©”£
¢Ś¼ģŃéĀĖŅŗBÖŠŹĒ·ń»¹ŗ¬ÓŠĢśŌŖĖŲµÄ·½·ØĪŖ£ŗ________£Ø×¢Ć÷ŹŌ¼Į”¢ĻÖĻ󣩔£
¢Ū½«ĀĖŅŗBÖŠµÄĀĮŌŖĖŲŅŌ³ĮµķŠĪŹ½Īö³ö£¬æÉŃ”ÓƵÄ×īŗĆŹŌ¼ĮĪŖ___£ØĢī“śŗÅ£©”£
a£®ĒāŃõ»ÆÄĘČÜŅŗ b£®ĮņĖįČÜŅŗ c£®°±Ė® d£®¶žŃõ»ÆĢ¼
¢ÜÓÉĀĖŅŗBÖʱøĀČ»ÆĀĮ¾§ĢåÉę¼°µÄ²Ł×÷ĪŖ£ŗ±ßµĪ¼ÓÅØŃĪĖį±ßÕō·¢ÅØĖõ”¢ĄäČ“½į¾§”¢____£ØĢī²Ł×÷Ćū³Ę£©”¢Ļ“µÓ”£
£Ø2£©SiO2ŗĶNaOH±ŗÉÕÖʱø¹čĖįÄĘ£¬æɲÉÓƵÄ×°ÖĆĪŖ___£ØĢī“śŗÅ£©”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŅ¹śÄ³µŲ·ŪĆŗ»ŅÖŠļŲŗ¬Įæ·įø»£¬ĘäÖ÷ŅŖ³É·ÖŅŌGa2O3µÄŠĪŹ½“ęŌŚ£¬³ż“ĖÖ®Ķā»¹ŗ¬ÓŠA12O3”¢Fe3O4”¢SiO2µČŌÓÖŹ”£ŅŃÖŖ“Ó·ŪĆŗ»ŅÖŠ»ŲŹÕļŲµÄŅÕĮ÷³ĢČēĶ¼¼×ĖłŹ¾”£

ŠÅĻ¢£ŗ(i)×ŖŠĶŅŗÖŠļŲŅŌGaO2£µÄŠĪŹ½“ęŌŚ£»
(ii)Ksp[Ga(OH3)]=1.4”Į10£34£¬Ksp[Fe(OH)3]=2.7”Į10£39£¬Ksp[Fe(OH)2]=4.87”Į10£17”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ĀĖŌüAÖŠŅ»¶Øŗ¬ÓŠµÄ³É·ÖŹĒ___________”£
(2)”°Ńõ»Æ”±¹ż³ĢÖŠ¼ÓČėH2O2µÄÄæµÄŹĒ___________£¬øĆ¹ż³ĢÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________”£
(3)Ļ“ĶŃŅŗÖŠ»¹ÓŠÉŁĮæµÄFe3+”¢Ga3+£¬ĘäÖŠGa3+ÅضČĪŖ1.4”Į10£4mol/L£¬ĮŠŹ½¼ĘĖćµ±Fe3+Ē”ŗĆ³ĮµķĶźČ«Ź±[c(Fe3+)”Ü1.0”Į10£5mol/L]£¬G a3+ŹĒ·ńæŖŹ¼³Įµķ___________”£
(4)Į÷³ĢĶ¼ÖŠĮ½“Īµ÷½ŚpHµÄÄæµÄ·Ö±šŹĒ___________”£
(5)µē½ā·ØæÉŅŌĢį“æ“ÖļŲ£¬¾ßĢåŌĄķČēĶ¼ŅŅĖłŹ¾¢Ł“ÖļŲÓėµēŌ“___________¼«ĻąĮ¬(Ģī”°Õż”±»ņ”°øŗ”±)”£¢ŚļŲŌŚŃō¼«ČܽāÉś³ÉµÄGa3+ÓėNaOHČÜŅŗ·“Ӧɜ³ÉGaO2££¬GaO2£ŌŚŅõ¼«·ÅµēµÄµē¼«·“Ó¦Ź½ĪŖ___________”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖij”°84Ļū¶¾Ņŗ”±ĘæĢå²æ·Ö±źĒ©ČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
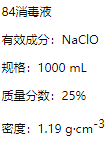
(1)øĆ”°84Ļū¶¾Ņŗ”±µÄĪļÖŹµÄĮæÅضČŌ¼ĪŖ________molL-1”£(±£Įō2Ī»ÓŠŠ§Źż×Ö)
(2)øĆĶ¬Ń§²ĪŌÄøĆ”°84Ļū¶¾Ņŗ”±µÄÅä·½£¬ÓūÓĆNaClO¹ĢĢåÅäÖĘ480 mLŗ¬NaClOÖŹĮæ·ÖŹżĪŖ25%µÄĻū¶¾Ņŗ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ________(Ģī×ÖÄø).
A£®ČēĶ¼ĖłŹ¾µÄŅĒĘ÷ÖŠ£¬ÓŠČżÖÖŹĒ²»ŠčŅŖµÄ£¬»¹ŠčŅŖŅ»ÖÖ²£Į§ŅĒĘ÷
B£®ČŻĮæĘæÓĆÕōĮóĖ®Ļ“¾»ŗó£¬Ó¦ŗęøÉŗó²ÅÄÜÓĆÓŚČÜŅŗÅäÖĘ
C£®ÅäÖĘ¹ż³ĢÖŠ£¬Ī“ÓĆÕōĮóĖ®Ļ“µÓÉÕ±ŗĶ²£Į§°ōæÉÄܵ¼ÖĀ½į¹ūĘ«µĶ
D£®ŠčŅŖ³ĘĮæNaClO¹ĢĢåµÄÖŹĮæĪŖ143.0g
(3)”°84Ļū¶¾Ņŗ”±ÓėĻ”ĮņĖį»ģŗĻŹ¹ÓĆæÉŌöĒæĻū¶¾ÄÜĮ¦£¬Ä³Ļū¶¾Š”×éČĖŌ±ÓĆ98%(ĆܶČĪŖ1.84gcm-3)µÄÅØĮņĖįÅäÖĘ200mL 2.3 molL-1µÄĻ”ĮņĖįÓĆÓŚŌöĒæ”°84Ļū¶¾Ņŗ”±µÄĻū¶¾ÄÜĮ¦”£
¢ŁŠčŅŖĮæČ”ÅØĮņĖįµÄĢå»żĪŖ________mL£»(±£Įō2Ī»ÓŠŠ§Źż×Ö)
¢Ś¶ØČŻŹ±ĻņČŻĮæĘæ֊עČėÕōĮóĖ®£¬ŅŗĆęĄėæĢ¶ČĻßĻĀ________Ź±£¬øÄÓĆ½ŗĶ·µĪ¹ÜµĪ¼ÓÕōĮóĖ®ÖĮ________ĻąĒŠ£»
¢ŪŌŚ×ŖŅĘŅŗĢåĒ°ŠčŅŖ×¢ŅāµÄŹĒ(ČŻĮæĘæŅŃ²éĀ©ĒŅĻ“µÓøɾ»)________________________£»
¢ÜĻĀĮŠ²Ł×÷»įŹ¹ÅäÖʵÄĻ”ĮņĖįĪļÖŹµÄĮæÅضČĘ«“óµÄŹĒ________£»
A£®ČŻĮæĘæÓĆÕōĮóĖ®Ļ“µÓŗó²ŠĮōÓŠÉŁĮæµÄĖ®
B£®ĮæČ”ÅØČÜŅŗ¶ĮŹżŹ±ŃöŹÓæĢ¶ČĻß
C£®ŅĘŅŗŹ±²£Į§°ōŌŚæĢ¶ČĻßŅŌÉĻ
D£®¶ØČŻ¹Ū²ģŅŗĢåŹ±ø©ŹÓæĢ¶ČĻß
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ槷Č÷·Ėį¾ßÓŠ½Ļ¹ć·ŗµÄæ¹¾ś×÷ÓĆ£¬Ęä½į¹¹¼ņŹ½ČēĻĀĶ¼ĖłŹ¾£ŗ

¹ŲÓŚæ§·Č÷·ĖįµÄĻĀĮŠŠšŹöÕżČ·µÄŹĒ(””””)
A£®·Ö×ÓŹ½ĪŖC16H13O9
B£®1 mol槷Č÷·ĖįæÉÓėŗ¬8 mol NaOHµÄČÜŅŗ·“Ó¦
C£®ÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗĶŹÉ«£¬ĖµĆ÷·Ö×Ó½į¹¹ÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü
D£®ÓėÅØäåĖ®ÄÜ·¢ÉśĮ½ÖÖĄąŠĶµÄ·“Ó¦
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com