
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:分析 (1)3min时Y增加0.7mol-0.4mol=0.3mol,X减少1mol-0.4mol=0.6mol,则Y与X的变化量之比为0.3mol:0.6mol=1:2;
(2)降低温度,反应速率减小;
(3)反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快;
(4)结合v=$\frac{△c}{△t}$计算;
(5)转化率=$\frac{转化的量}{开始的量}$×100%、M=$\frac{m}{n}$,以此来解答.
解答 解:(1)3min时Y增加0.7mol-0.4mol=0.3mol,X减少1mol-0.4mol=0.6mol,则Y与X的变化量之比为0.3mol:0.6mol=1:2,由2NO2(g)?N2O4(g)可知,X表示NO2的物质的量随时间的变化曲线,
故答案为:X;
(2)若降低温度,则v(正)减慢,v(逆)减慢,故答案为:减慢;减慢;
(3)测得甲中v(NO2)=0.003mol/(L•s),乙中v(N2O4)=0.06mol/(L•min),则$\frac{0.003}{2}$=0.0015>$\frac{\frac{0.06}{60}}{1}$=0.001,则甲中反应速率快,
故答案为:甲;
(4)在0到3min中内N2O4的反应速率为$\frac{\frac{0.3mol}{2L}}{3min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min);
(5)由上述分析可知,2NO2(g)?N2O4(g)正向移动,达到反应限度时反应物的转化率为$\frac{1mol-0.4mol}{1mol}$×100%=60%;由图可知,平衡时为NO20.4mol、N2O4为0.7mol,M=$\frac{46g/mol×0.4mol+92g/mol×0.7mol}{0.4mol+0.7mol}$=75.3g/mol,此时混合气体的平均相对分子质量为75.3,
故答案为:60%;75.3.
点评 本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量变化、反应速率的影响因素及计算、转化率及相对分子质量的计算等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:
一定温度下,某容积为2L的密闭容器内,某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如图,依图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=12的溶液:K+、Na+、CH3COO-、Br- | |
| B. | 由水电离出c(H+)=10-3mol/L的溶液中:Na+、[Al(OH)4]-、NO3-、HCO3- | |
| C. | 无色溶液中可能大量共存在Fe3+、NH4+、Cl-、S2- | |
| D. | 1mol/L的KNO3溶液:H+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
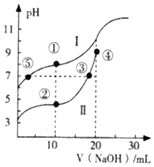 常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为 0.10mol•L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中:c(CN-)=c(CH3COO-) | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com