
| A. | O2被还原 | |
| B. | 该反应是置换反应 | |
| C. | NH3是氧化剂 | |
| D. | 若有17gNH3参加反应,则反应中转移的电子数为10 mol |
分析 4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O反应中N元素的化合价升高,则NH3为还原剂被氧化,O元素的化合价降低,则O2为氧化剂被还原,结合氧化还原反应的有关概念分析.
解答 解:A、4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O反应中N元素的化合价升高,则NH3为还原剂被氧化,O元素的化合价降低,则O2为氧化剂被还原,故A正确;
B、置换反应的特征是反应物生成物均是由一种单质和一种化合物组成,而该反应的生成物是两种化合物,所以该反应不是置换反应,故B错误;
C、4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O反应中N元素的化合价升高,则NH3为还原剂被氧化,故C错误;
D、4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O反应中N元素的化合价由-3升高到+2,所以若有17gNH3参加反应,则反应中转移的电子数为$\frac{17}{17}$×5=5mol,故D错误;
故选A.
点评 本题考查了氧化还原反应,侧重于基本概念的考查,注意根据化合价的变化分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 以NaOH溶液为电解液时,负极反应为Al+3OH--3e-═Al(OH)3↓ | |
| B. | 以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e-═4OH- | |
| C. | 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 | |
| D. | 电池工作时,电子通过外电路从正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+ Na+CO32- Cl- | B. | K+、Al3+、Cl-、OH- | ||
| C. | Fe3+、Al3+、SCN-、Cl- | D. | Ag+ Al3+ NO3-H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭与炽热的水蒸气反应制取水煤气 | |
| B. | 铜丝在氯气中燃烧 | |
| C. | 高温煅烧石灰石 | |
| D. | 氢氧化钡晶体与氯化铵固体混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 一束平行光线射入蛋白质溶液中,从侧面可以看到一束光亮的通路 | |
| C. | 黄河入海口形成了三角洲 | |
| D. | 将二氧化碳通入澄清石灰水中,一段时间后,石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
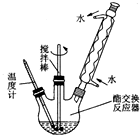 为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:
为了综合利用地沟油,我国将地沟油提炼成生物柴油可替换柴油做燃料,目前技术已经非常成熟.生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换生成新酯和新醇得到.已知油脂与甲醇互不相溶,反应中若有游离脂肪酸和水,将妨碍酯的交换.酯交换反应为:R1COOR2+R3OH→R1COOR3+R2OH.地沟油的预处理过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com