

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 9.6 |
分析 (1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)当氢氧化钙过量时,溶液碱性增强,Al(OH)3会溶解,从氢氧化物沉淀的pH表中可看出,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀;
(3)红色氧化物为Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质;
(4)此过程中CO2是可以重复使用的;
(5)确定产品aMgCO3•bMg(OH)2•cH2O中a、b、c的值,需要测定的数据是①样品质量;②MgO质量;③生成CO2的质量(或体积);④生成水的质量;
解答 解:(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去.故答案为:Fe3+、Al3+;
(2)由(1)知,此时溶液中除了Mg2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Mg2+,因Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,利用平衡移动的原理,消耗H+使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀,同时Mg2+也因转化为沉淀而损失.
故答案为:Al(OH)3 Mg(OH)2;
(3)从实验步骤图知:沉淀混合物为Fe(OH)3和Al(OH)3,红色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加碱把Al(OH)3除掉,反应为:Al(OH)3+NaOH=NaAlO2+2H2O,然后过滤洗涤灼烧即可;
故答案为:NaOH或Ca(OH)2 过滤、洗涤、灼烧;
(4)从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是CaCO3或CO2.
故答案为:碳酸钙或二氧化碳;
(5)m(样品)=32.8g,m(CO2)=13.2g,m(MgO)=16.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O $\frac{\underline{\;高温\;}}{\;}$(a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=32.8g-13.2g-16.0g=3.6g,则n(MgO)═$\frac{16g}{40g/mol}$=0.4mol,n(CO2)═$\frac{13.2g}{44g/mol}$=0.3mol,n(H2O)═$\frac{3.6g}{18g/mol}$=0.2mol,得:a:b:c=0.3:(0.4-0.3):(0.4-0.3+0.2)=3:1:3,
故答案为:3:1:3.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.186 | 0.160 | 0.102 | 0.074 |
| 主要化合价 | +1 | +2 | -2、+4、+6 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | X和W能组成两种化合物 | |
| C. | Y和W属于同周期的元素 | |
| D. | Z和W属于同主族元素,其单质能直接化合生成ZW3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C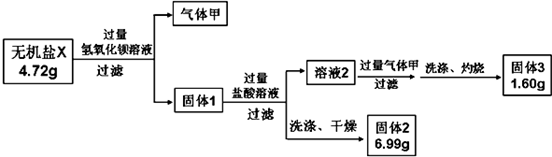
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵和过氧化氢的分解 | B. | 二氧化硅与二氧化碳的熔化 | ||
| C. | 蔗糖和干冰的熔化 | D. | 氯化镁和氯化铝的熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com