
| A. | ①和②混合后,酸碱恰好中和,溶液呈中性 | |
| B. | ①和③中均有c(F-)+c(HF)=0.1mol/L | |
| C. | ①和③混合:c(F-)+c(OH-)=c(H+)+c(HF) | |
| D. | 由水电离出来的c(OH-):②>③>① |
分析 A.HF酸为弱酸,与KOH反应生成强碱弱酸盐;
B.根据物料守恒判断;
C.①和③混合,HF电离程度大于F-水解程度,结合电荷电荷守恒判断;
D.KF水解,促进水的电离.
解答 解:A.HF酸为弱酸,与KOH反应生成强碱弱酸盐,酸碱恰好中和,溶液呈碱性,故A错误;
B.浓度均为0.1mol/L的①和③,溶液中均存在HF、F-,由物料守恒可知c(F-)+c(HF)=0.1mol/L,故B正确;
C.①和③混合,由电荷守恒可知c(F-)+c(OH-)=c(H+)+c(K+),HF电离程度大于F-水解程度,则c(K+)>c(HF),所以c(F-)+c(OH-)>c(H+)+c(HF),故C错误;
D.KF水解,促进水的电离,由水电离出来的c(OH-):③>②>①,故D错误.
故选B.
点评 本题考查弱电解质的电离,为高考常见题型,题目难度中等,明确酸碱混合的判断,盐类水解的规律等知识即可解答,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焊接铁轨:2Fe+Al2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Al+Fe2O3 | |
| B. | 工业固氮:N2+3H2 $?_{催化剂}^{高温、高压}$ 2NH3 | |
| C. | 用纯碱除油污:CO32-+H2O?HCO3-+OH- | |
| D. | 用湿润的淀粉KI试纸检验Cl2:Cl2+2I-═2Cl-+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气溶于水能导电,故氨气属于电解质 | |
| B. | 碳酸钡难溶于水,故碳酸钡属于弱电解质 | |
| C. | 硫酸是强电解质,故纯硫酸能导电 | |
| D. | 室温下,氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Y)>r(Z )>r(W)>r(M) | |
| B. | Z的气态氢化物比W的气态氢化物更稳定 | |
| C. | 分子式为Y5X12的物质只有3种 | |
| D. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C | B. | N | C. | S | D. | C1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 非金属性:甲<丙 | B. | 原子半径:乙<丁 | ||
| C. | 最外层电子数:乙<丙 | D. | 戊一定是硫元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
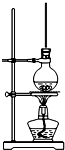 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com