
| A. | 剩余固体是铁、铜混合物 | |
| B. | 反应后溶液中n (Fe2+)+n(Cu2+)=0.75 mol | |
| C. | 反应后溶液中n (Fe3+)=0.10 mol | |
| D. | 原固体混合物中铜的质量是8.0g |
分析 铁比铜活泼,与FeCl3溶液反应时先后发生Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+,n(FeCl3)=0.5mol,结合反应的方程式解答.
解答 解:铁的还原性强于铜,把其加入氯化铁溶液中,铁先与铁离子反应,氯化铁的物质的量是0.5mol,
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
m1=16g,m2=14g,溶解的金属质量是18-3.2=14.8,则两种金属都参与反应,Fe3+完全反应,剩余的金属是铜,故A、C错;
列方程进行计算,设反应的铜的物质的量是n1,反应的铁是n2
64n1+56n2=14.8g
n1+n2=0.25mol
n1=0.1mol,
n2=0.15mol,
则原来含有的铜的质量是:0.1mol×64g/mol+3.2g=9.6g,故D错误;
溶液中的n(Fe2+)+n(Cu2+)=0.25mol+0.5mol=0.75mol,故B正确.
故选B.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意根据反应的相关方程式从质量守恒的角度解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 使用分液漏斗前不用检查活塞处是否漏水 | |
| B. | 放气时,直接打开上口玻璃塞 | |
| C. | 分液操作时,下层液体从下端放出,上层液体从上口倒出 | |
| D. | 应选用球形分液漏斗进行分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.
;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO的电子式为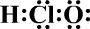 | |
| B. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| C. | CH3COOH溶液和NaCl溶液均通过离子导电,说明CH3COOH和NaCl中均含离子键 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有较强的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 高压除尘 | |
| D. | 黄河入海口处容易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com