
CuSO4溶液对过氧化氢的分解具有催化作用,有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
(1)请你帮助他们完成实验报告:
实验过程:在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:①
实验结论:FeCl3溶液可以催化分解H2O2
(2)以知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想:
甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 ② 同学的猜想, 理由是 ③ 。
(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管。
实验现象:无明显现象
结论④ 。
实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的⑤ ,并把带火星的木条伸入试管.
实验现象:⑥ 。
结论:⑦ 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:江西省九江市第一中学2011-2012学年高二下学期第一次月考化学试题 题型:058
某课外小组利用乙炔与酸性KMnO4溶液反应,测定乙炔的相对分子质量.下图是测定装置示意图.
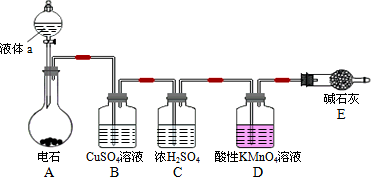
(1)实验室制取乙炔时,分液漏斗中的液体a通常是________.
(2)CuSO4溶液的作用是________.
(3)写出实验制室取乙炔的化学方程式________.
(4)该小组实验如下:实验前,D装置中KMnO4的物质的量为x mol.实验完毕,D及E装置的总质量共增重y g,此时D中过量的KMnO4恰好能与含z mol FeSO4的溶液完全反应(注:反应中MnO4-被还原成Mn2+,Fe2+被氧化成Fe3+).则所测乙炔的相对分子质量是(请用含字母x、y、z的代数式表示)________.
(5)若该小组实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项)________.
A.装置A中产生的气体直接通入酸性KMnO4溶液
B.乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出
C.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
(6)另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?
答:a.实验装置改进________.
b.实验操作改进________.
查看答案和解析>>
科目:高中化学 来源:江西省新余一中2011-2012学年高二下学期第一次段考化学试题 题型:058
某课外小组利用乙炔与酸性KMnO4溶液反应,测定乙炔的相对分子质量.下图是测定装置示意图.
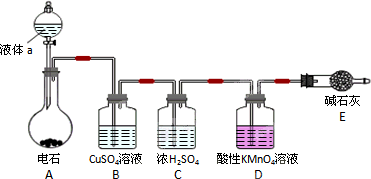
(1)实验室制取乙炔时,分液漏斗中的液体a通常是________.
(2)CuSO4溶液的作用是________.
(3)配平乙炔与酸性KMnO4溶液反应的化学方程式(请在方框中填计量系数):
□C2H2+□KMnO4+□H2SO4-□K2SO4+□MnSO4+□CO2↑+□H2O
(4)该小组实验如下:实验前,D装置中KMnO4的物质的量为x mol.实验完毕,D及E装置的总质量共增重y g,此时D中过量的KMnO4恰好能与含z mol FeSO4的溶液完全反应(注:反应中MnO4-被还原成Mn2+,Fe2+被氧化成Fe3+).则所测乙炔的相对分子质量是(请用含字母x、y、z的代数式表示)________.
(5)若该小组实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项)________.
A.装置A中产生的气体直接通入酸性KMnO4溶液
B.乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出
C.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
(6)另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?
答:________.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省新余一中高二下学期第一次段考化学试卷 题型:实验题
(12分)某课外小组利用乙炔与酸性KMnO4溶液反应,测定乙炔的相对分子质量。下图是测定装置示意图。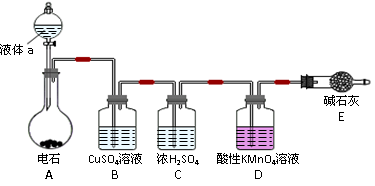
⑴实验室制取乙炔时,分液漏斗中的液体a通常是 。
⑵CuSO4溶液的作用是 。
⑶配平乙炔与酸性KMnO4溶液反应的化学方程式(请在方框中填计量系数):
□C2H2+□KMnO4+□H2SO4—□K2SO4+□MnSO4+□CO2↑+□H2O
⑷该小组实验如下:实验前,D装置中KMnO4的物质的量为x mol。实验完毕,D及E装置的总质量共增重y g,此时D中过量的KMnO4恰好能与含z mol FeSO4的溶液完全反应(注:反应中MnO4- 被还原成Mn2+,Fe2+被氧化成Fe3+)。则所测乙炔的相对分子质量是(请用含字母x、y、z的代数式表示) 。
⑸若该小组实验原理及所有操作均正确,则下列各因素对所测乙炔的相对分子质量没有影响的是(填选项) 。
A.装置A中产生的气体直接通入酸性KMnO4溶液
B.乙炔通过酸性KMnO4溶液的速率过快,少量乙炔未被氧化而逸出
C.将E装置(盛有碱石灰的干燥管)换成盛有浓硫酸的洗气瓶
⑹另一课外小组认为,该课外小组的实验装置及实验操作存在不足,请用简明文字说明,应采取何种措施或改进?答: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(08上海松江区模拟)过碳酸钠是由碳酸钠和过氧化氢复合形成的一种新型氧系漂白剂,具有碳酸钠和过氧化氢的双重性质,其分子式为2Na2CO3?3H2O2,已知过渡元素的金属离子可作为催化剂使之分解。
它的制备原理和湿法生产路线如下:2Na2CO3 + 3H2O2 → 2 Na2CO3?3H2O2
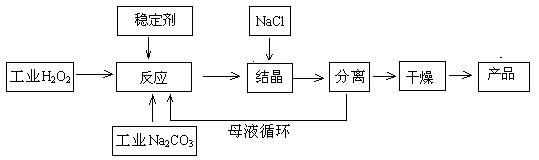 |
回答下列问题:
(1)反应控制在0~5℃条件下进行,其主要原因是 ,流程中的“分离”指的是实验操作中的 ;
(2)工业碳酸钠中一般含有少量锰、铜等金属离子(用M2+表示),加入稳定剂的作用是将M2+沉淀而除去,M2+对产品的不良影响是 ,
若加入的稳定剂是Na2SiO3,反应的离子方程式为 ;
(3)加入的食盐为盐析剂,其原理是降低过碳酸钠的溶解度使之析出。盐析是物理变化还是化学变化? ;
(4)过碳酸钠在生产上的应用是利用它分解所释放的H2O2。以铜为原料用H2O2氧化是工业上制胆矾的方法之一。做法是:
将铜丝放到一定量的稀硫酸中,控温在50℃,加入一定量的H2O2溶液,反应0.5h后,升温到60℃,再持续反应1 h,过滤后取滤液,再经过“某些操作”、减压抽滤,用少量95%的酒精淋洗后晾干,可得CuSO4?5H2O。
①在反应中,起氧化作用的是H2O2,写出H2O2在稀硫酸中氧化单质铜的化学反应方程式 ;
②处理滤液时的“某些操作”指的是 ;
③晶体采用酒精淋洗的优点是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com