
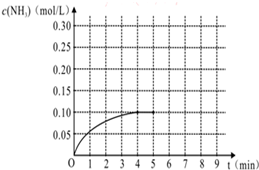
 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图: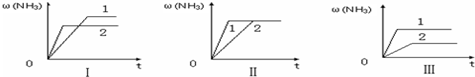
分析 (1)升高温度,平衡向吸热方向移动;
(2)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(3)只把容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,温度不变,平衡常数不变;
(4)先判断把容器的体积缩小一半的瞬间氨气的浓度,再结合平衡时的浓度作图;
(5)A.增大压强平衡右移;
B.压强不同,平衡状态不同;
C.升高温度反应速率加快,平衡逆向移动;
D.催化剂不影响平衡移动.
解答 解:(1)正反应放热,则升高温度,平衡逆向移动,平衡常数减小,故答案为:减小;
(2)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,故答案为:ac;
(3)只把容器的体积缩小一半,压强增大,平衡向正向移动,温度不变,平衡常数不变,故答案为;向正反应方向;不变;
(4)把容器的体积缩小一半的瞬间氨气的浓度,氨气的浓度变为0.20mol/L,平衡后浓度约为0.25mol/L,所以第5分钟末到此平衡时NH3浓度的变化曲线为: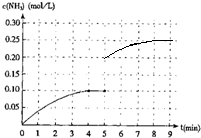 ,故答案为:
,故答案为: ;
;
(5)A.增大压强平衡右移,氨气的含量应增大,图象与实际不符,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,图象与实际不符,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,图象与实际不符,故C错误;
D.催化剂不影响平衡移动,由图象可知1到达平衡时间过短,故催化剂性能1>2,故D正确.
故答案为:D.
点评 本题考查化学平衡的计算与影响因素、化学平衡图象、化学平衡的建立等,为高频考点,侧重考查学生的分析能力,题目难度中等,(4)中作图注意缩小体积瞬间,氨气浓度变为原来的2倍.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 | |
| B. | 红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 | |
| C. | 卤素单质(X2)与水反应均可用X2+H2O=HX+HXO表示 | |
| D. | 溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层颜色变浅,下层颜色变为橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe与A1的物质的量之比为1:1 | |
| B. | 混合气体中 NO为0.03mol,N2O0.12mol | |
| C. | 原HNO3溶液的浓度C=4.6mol/L | |
| D. | 反应中被还原的HNO3为0.18 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com