
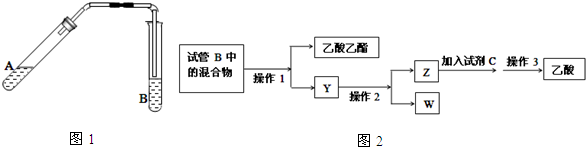
分析 (1)浓硫酸起到了催化作用和吸水作用;
(2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;根据导管伸入液面下可能发生倒吸分析;
(3)液体加热要加碎瓷片,防止暴沸;
(4)①分离互不相溶的液体,可用分液的方法分离;
②分离沸点不同且互溶的液体用蒸馏操作;Y为乙酸钠、碳酸钠和乙醇的混合溶液,乙醇的沸点较低;
③Z中的乙酸钠与酸反应生成乙酸;
④乙醇催化氧化生成乙醛和水.
解答 解:(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,浓硫酸的作用为催化剂,吸水剂,
故答案为:催化剂;吸水剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:饱和碳酸钠溶液;防止倒吸;
(3)液体加热要加碎瓷片,引入汽化中心,可防止溶液暴沸,
故答案为:防止暴沸;
(4)①分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,
故答案为:分液;
②分离沸点不同且互溶的液体用蒸馏操作,Y为乙酸钠、碳酸钠和乙醇的混合溶液,乙醇的沸点较低,因此W为乙醇,
故答案为:蒸馏;乙醇;
③Z中的乙酸钠与酸反应方可生成乙酸,
故答案为:A.
④W为乙醇,乙醇发生催化氧化的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查乙酸乙酯的制备,涉及酯化反应的制备反应装置,反应条件,反应特征等分析判断、分离混合物的操作步骤和方法选择和实验评价的分析等方面,题目难度中等.


科目:高中化学 来源: 题型:选择题
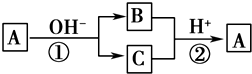 A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去).下列说法正确的是( )| A. | 反应①和②互为可逆反应 | B. | X元素可能为铝 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | 反应①和②一定为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH溶液中混有Ba(OH)2 (CuSO4) | B. | Cu(NO3)2中混有AgNO3 (Cu粉) | ||
| C. | CO中混有CO2(炽热的炭) | D. | CO2中混有HCl气体 (NaOH溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 烷烃名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 |
| 沸点(℃) | -88.6 | -42.1 | 36.1 | |
| 燃烧热(kJ•mol-1) | 1560.7 | 2877.6 | 3535.6 |
| A. | 丁烷的沸点有可能在0℃以下 | |
| B. | 上述四种烷烃中戊烷最容易液化,打火机中所用的燃料就是戊烷 | |
| C. | 丙烷完全燃烧生成4mol气态水,所放出的热量小于2877.6kJ | |
| D. | 烷烃的含碳量越高,其燃烧热值也就越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向淀粉溶液中加入稀硫酸加热后,再用NaOH中和,并做新制氢氧化铜反应实验--检验淀粉是否水解 | |
| B. | 向1-溴丙烷中加入氢氧化钠溶液并加热,再滴加硝酸银和稀硝酸溶液--检验有机物中是否含有溴元素 | |
| C. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| D. | 向含苯酚的苯溶液中滴加浓溴水,过滤--除去苯中的苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1000 ml | B. | 500 ml | C. | 1500 ml | D. | 100 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com