
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )

|
| A. | 图中N表示HA,P表示OH﹣,Q表示H+ | B. | 若V=10 mL,则pH=7 |
|
| C. | 若V<10 mL,则溶液显酸性 | D. | 若V=10 mL,则:c(M)+c(P)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能. 已知部分化学键的键能如下:
| 化学键 | N—H | N—N | O==O | N≡N | O—H |
| 键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1 mol肼完全燃烧时放出的热量为________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,Na2CO3溶液中存在CO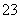 +H2O
+H2O HCO
HCO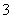 +OH-平衡。下列说法不正确的是 ( )
+OH-平衡。下列说法不正确的是 ( )
A.稀释溶液,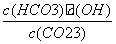 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.加入NaOH固体,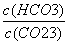 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是_________________。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c 0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度
c(A-)_____c(Na+)(选填“>”、“<”或“=”)从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”)。
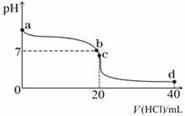 Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。 (1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中,正确的是( )
A.二氧化氮与水反应:3NO2+H2O===NO+2H++2NO3-
B.二氧化硫与氢氧化钠溶液反应:SO2+OH-===SO32-+H2O
C.硫酸与氢氧化钡溶液反应:H++OH-===H2O
D.氧化铝与氢氧化钠溶液反应:Al2O3+2OH-===2AlO2-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)某酯的分子式为C6H12O2,其变化如图所示:
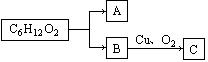
若A能发生银镜反应,C不能发生银镜反应,则该酯的可能结构有 种。
(2)将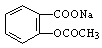 转变为
转变为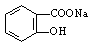 的流程为
的流程为
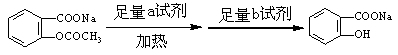
则a试剂是 ,b试剂是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、
另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6
pm,则此晶胞的密度为 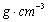 (保留两位有效数字)。(
(保留两位有效数字)。( )
)
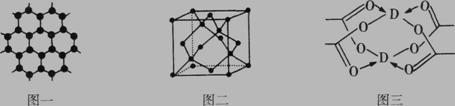
(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构
如图三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出
上述过程的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com