
����Ŀ����������п(ZnO)��������1-100 nm֮�䣬��һ������21���͵����߹��ܾ�ϸ����Ʒ�����ֳ�������������ʡ�ij�о����Դ�����п��������CuO��FeO��MnO��Fe2O3�ȣ�Ϊԭ�ϣ�����ʪ��ѧ��(NPP-��)�Ʊ�������������п����������������ͼ��
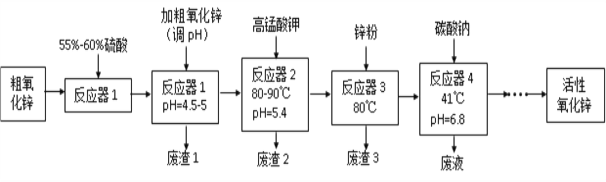
��֪��
��pH=5.4ʱ��KMnO4�Ļ�ԭ����ΪMnO2��
������ʵ�������¸����������������pH������±���ʾ��
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
��ʼ������pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
������ȫ��pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
����������Ϣ���ش��������⣺
��1�����չ����и�������õ��ķ��뷽����_______________________________��
��2��������1������Ҫ�ɷ���______________________________________________��
��3������Ӧ��2��������������ԭ��Ӧ�����ӷ���ʽΪ_______________________________________________________________
��4�� ����Ӧ��3���м���п�۵�������________________________________��
��5������Ӧ��4���õ��ķ�Һ�У����е���Ҫ���ӳ���Na+�⣬����______________��
���𰸡� ���� Fe(OH)3 MnO4�� + 3Fe2+ + 4H+ = 3Fe3+ + MnO2��+ 2H2O��2MnO4�� +3Mn2++2H2O = 5MnO2��+ 4H+ ��ȥ��Һ��Cu2+ K+��SO42��
����������1�����⿼�����ʵij��Ӻͷ��룬�������̣�������õ�������Һ����������˷��뷽���ǹ��ˣ���2�����⿼�����ܵ�����ܽ�ƽ���Ӧ�ã���Ӧ��1���Ӵ�����п��Ŀ���ǵ���pH������4.5��5�����ݱ������ݣ�Fe3����������������ʽ����������������1ΪFe(OH)3����3�����⿼��������ԭ��Ӧ����ʽ����д�����ݴ�����п�ijɷ֣���Ӧ��1�к���Fe2������˼�����������Һ��Ŀ��֮һ�ǰ�Fe2��������Fe3����Ȼ�����pH����ȥ��������ӷ�Ӧ����ʽΪMnO4�� + 3Fe2�� + 4H�� = 3Fe3�� + MnO2��+ 2H2O�����ݴ�����п�ijɷ֣���Ӧ��1�еõ������ӻ�����Mn2������������ͼ���������Ը��������Һ��Ŀ��֮���dz�ȥMn2�������ӷ�Ӧ����ʽΪ2MnO4�� +3Mn2��+2H2O = 5MnO2��+ 4H�� ����4���������ʵij��ӣ������̵�Ŀ���ǵõ���������п�����ݷ�Ӧ��1��2����Ӧ��3��Ŀ���dz�ȥCu2����������ý�����ԣ�����Zn��Cu2��=Zn2��Cu������п��Ŀ���dz�ȥ��Һ��Cu2������5���������ӵĴ��ڣ���������ͼ����Ӧ��4�еķ�Һ�к���Na����K����SO42���ȡ�


 ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д�
ֱͨ������У�ܲ��¿�ֱͨ��Уϵ�д� ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�鷽����,���Դﵽ��Ӧʵ��Ŀ�ĵ���
A | B | C | D | |
�� �� |
|
|
|
|
Ŀ �� | ��֤��ͬ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� | �����Ҵ���ˮ | ��п�廻��ͭ�� �Ը�բ�ű���Ч������ | ��֪��Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3�� ��֤�ǽ����ԣ�C > Si |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ҩ���˵����ȷ���ǣ�������
A.ҩ��ķ��ü���Խ������Ч��Խ����
B.��װ��ӡ�С�OTC����־��ҩƷ���ڴ���ҩ
C.�������������������������������
D.���ڴ������ð�˾ƥ�ֿ�Ԥ��ijЩ������û�и�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ�ķ�������ij��ѧ��ȤС����̼��Ũ����Ϊ��ʼԭ�ϣ��������װ������һ��������������Ʒ�Ӧ�Ʊ��������ƣ����г�װ�ú�A�м���װ�����ԣ��������Ѽ��飩 
�������ϣ���HNO2Ϊ���ᣬ�����´��ڷ�Ӧ3HNO2�THNO3+2NO��+H2O��
��NO����Ӧ���ɱ�����KMnO4��Һ����Ϊ���ᡣ
ʵ��������ٹرյ��ɼУ���A�з�Һ©���������μ�һ����Ũ���ᣬ���ȣ�
��һ��ʱ���ֹͣ���ȡ�
(1)A�з�Ӧ�Ļ�ѧ����ʽ��_________________________________________��
(2)B�й۲쵽����Ҫ������_______________________��Dװ�õ�������___________________��
(3)ʵ�龭�Ľ�����Ƶýϴ��������ƣ����й����������Ƶ�˵����ȷ����________��
a��������������ζ���ɴ���ʳ��ʳ��
b�������£�0.1mol/L��������ҺpH=1
c��0.1mol/L����������Һ�д��ڣ�c��Na+��+c��H+��=c��NO2����+c��OH����
d��0.1mol/L����������Һ�д��ڣ�c��NO2������c��Na+����c��OH������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������Ԫ��Q��T��U��V��W��X��Y��Zԭ����������������֪��T��U��Vͬ���ڣ�W��X��Y��Zͬ���ڣ�U��Yͬ�壻Ԫ��Q��ij�ֺ���û�����ӣ�Ԫ��T���������������۵Ĵ�����Ϊ0��Q��U�γɵ���̬�������ڱ�״���µ��ܶ�Ϊ0.76g/L����ҵ��ͨ������Һ̬�������V�ĵ��ʣ��Ҹõ��ʵ�ij��ͬ���������DZ�������ر���������Ҫ���ϣ�W��X��Z������������Ӧ��ˮ��������֮�䶼�ܷ�Ӧ����W��X��Zԭ������������֮�͵���W��ԭ��������
(1)VԪ��ԭ�ӵ� L�������Ϊ______��Ԫ�� W �����ڱ��е�λ��Ϊ______��
(2)�õ���ʽ��ʾ������ QZ���γɹ���______��
(3)U���⻯���ͬ��������Ԫ�ص��⻯����۷е�����ƫ�ߣ�ԭ����______��
(4)д��X��Z ����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��______��
(5)T��U��V�γɵ��⻯������й��ۼ��ļ�����ǿ������˳��Ϊ______�����ѧʽ��
(6)Q��T���γ�һ�ֻ�����T2Q4����д���÷��ӵĽṹʽ________��
(7)Ԫ��Y��һ�ֺ����ữѧʽΪ H3YO3����ṹʽ�ɱ�ʾΪ��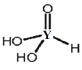 ������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ______��(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
������Ϊ______Ԫ�ᣬ��д���������������������Һ��Ӧ�Ļ�ѧ����ʽ______��(��֪��Ϣ������ԭ�ӽ�ϳɵ�һ��ԭ���š���OH�����ǻ�����������ֻ���ǻ���ſɵ���� H+��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��������ͼ��ʾװ��A��B�ֱ�̽������п��ϡ����ķ�Ӧ��ʵ�������A�ձ��ڵ���Һ�¶����ߣ�B�ձ��ĵ�����ָ�뷢��ƫת����ش��������⡣
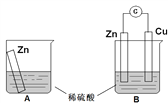
��1��A�ձ��з�Ӧ�����ӷ���ʽΪ_________��
��2��B��Zn����_________���������ĵ缫��Ӧ��_________��Cu���ϵ�������_________�������ĵ缫��Ӧ��_________��
��3��������ת���ĽǶ�������A��B�з�Ӧ���������_________������ڡ�����С�ڡ����ڡ�����������������A���ǽ���ѧ��ת��Ϊ_________��B����Ҫ�ǽ���ѧ��ת��Ϊ_________��
��4����С��ͬѧ��˼ԭ��ص�ԭ�������й۵���ȷ����_________������ĸ��ţ���
A��ԭ��ط�Ӧ�Ĺ�����һ���е���ת��
B��ԭ���װ����Ҫ2���缫
C���缫һ�����ܲμӷ�Ӧ
D��������Ӧ�ͻ�ԭ��Ӧ���Բ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�����������ʵ�飬̽�������´����Թ�������ֽⷴӦ��Ӱ�졣
�� | �� | �� | |
ʵ����� ʾ��ͼ |
|
|
|
ʵ������ | �м��������ݲ��� | ���������������мӿ� | ���������������Լӿ� |
��1��ʵ����������_______________��
��2��ʵ����з�Ӧ�Ļ�ѧ����ʽΪ_______________��
��3������ʵ���������IJ�ͬ�����Եó��Ľ����ǣ�
��ʹ�ú��ʵĴ����������˫��ˮ�ֽ�ķ�Ӧ���ʣ�
��_______________��
��4����һ���¶��£�10 mL 0.40 mol/L��H2O2��Һ�������ֽ⡣��ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V��O2��/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min����H2O2��Ũ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��H2O2����_________mol/��L��min��������������ȷ��0.001��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ���ɼס��Ҳ������(��ͼ��ʾ)�����ǽ���ˮ���Ҷ���[H2N(CH2)2NH2]����Ϊ�����Ѻ������γɵĻ�ѧ��Դ������ع���ʱ������˵����ȷ����
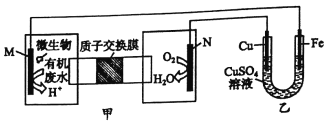
A. ���ӵ���������M��Fe��CuSO4��Һ��Cu-N
B. M���缫��Ӧʽ: H2N(CH2)2NH2+16OH--16e-==2CO2��+N2��+12H2O
C. ��N������5.6LO2ʱ������������32g
D. һ��ʱ�������CuSO4��ҺŨ�Ȼ������ֲ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com