
化学与工农业生产、环境保护、日常生活等方面有广泛联系,下列叙述正确的是
A.将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率
B.铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品
C.氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应”
D.大量使用含磷洗涤剂,可导致水体富营养化
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:填空题
(16分)金属铝、铁、铜及其化合物与生产、科研关系密切。
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应冶炼金属锰。用化学方程式表示其冶炼原理________。
(2)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN—(C为+4价。下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为C12+CNO—+OH— →□+Cl—+CO32-+H2O(未配平)。

①铁电极应连接直流电源的________________(填写电极名称)。
②上述反应方程式配平后“□”内应填写_______。
③阴极产物有______,阳极上发生的电极反应为2Cl--2e-=Cl2↑和______。
(3)用CuSO4溶液为电解质溶液,进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。下列说法错误的是___________(填写字母代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)硫酸铝铵水溶液呈酸性,是因为________(填写离子符号)发生了水解;常温下浓度均为0.1 mol·L-1硫酸铝和硫酸铝铵两种水溶液,c(Al3+)较大的是________(填“硫酸铝铵”或“硫酸铝”)溶液。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三5月一模化学试卷(解析版) 题型:选择题
下列实验操作不能达到其对应目的的是
序号 | 实验内容 | 实验目的 |
A. | 向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀 |
B. | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
C. | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
D. | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 | 验证淀粉已水解 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
(B)分子式为C6H12O2,属于乙酸乙酯同系物的同分异构体共有
A.12种 B.16种 C.20种 D.24种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
常温下,向10 mL0.1 mol·L-1的HCl溶液中逐滴加入0.1 mol·L-1的NH3·H2O溶液,其pH逐渐增大,图中a、b、c三点的pH为实验所测得。下列有关说法中一定错误的是

A.常温下,0.1 mol·L-1的HCl溶液的pH=1
B.当pH=7时,所加NH3·H2O溶液的体积大于10 mL
C.当7<pH<9时,溶液中c(NH4+ )>c(Cl-)
D.继续滴加0.1 mol·L―1的NH3·H2O溶液,溶液的pH最终可以变化至13
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:简答题
(14分)
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳 源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据是_____________。
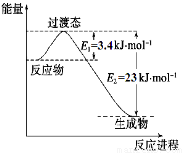
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K= 。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V正 V逆(填“<”,“>”,“=”)。
(3)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为________;
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三第二次联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是:
A.标准状况下,22.4L HF中含HF分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:简答题
(13分)硫、碳、氮等元素及其化合物与人类的生产生活密切相关,其中.硫酸、氨气、硝酸都是重要的化工原料.而SO2、NO、NO2、CO等相应氧化物又是主要的环境污染物:
(1)过度排放CO2会造成“温室效应”,而煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。
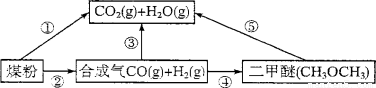
已知:C(s)+H2O(g)=CO(g)+H2(g) AH1= +131.3 kJ·mol-
C(s)十2H2O(g)=CO2(g)+2H2(g) AH2= +90 kJ·mol-
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)298 K时.将氨气放入体积固定的密闭容器中使其发生分解反应。当反应达到平衡状态后.改变其中一个条件X,Y随X的变化符合图中曲线的是 (填字号):

a.当X表示温度时,Y表示氨气的物质的量
b.当X表示压强时.Y表示氨气的转化率
c.当X表示反应时间时.Y表示混合气体的密度
d.当x表示氨气的物质的量时.Y表示某一生成物的物质的量
(3)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染.必须经脱除达标后才能排放:能作脱除剂的物质很多.下列说法正确的是 (填序号):
a.用H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
d.用尿素[CO(NH2)2]作脱除剂.在一定条件下能有效将NOx氧化为N2
(4)在压强为O.1 MPa条件下,容积为V L的密闭容器中,amol CO与2amol H2在催化剂作用下反应生成甲醇。反应的化学方程式为CO(g)+2H2(g)  CH3OH(g),CO的平衡转比率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转比率与温度、压强的关系如图所示,则:
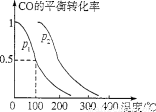
①P1 P2(填“>”“<”或“=”)。
②在其他条件不变的情况下,向容器中增加a molCO与2amol H2.达到新平衡时.CO的转化率 (填“增大””减小”或“不变”.下同),平衡常数 .
③在P1下、100℃时,CH3OH(g)  CO(g)十2H2(g)的平衡常数为 (用含a、V的代数式表示)。
CO(g)十2H2(g)的平衡常数为 (用含a、V的代数式表示)。
(5)①常温下.若将2 mol NH3(g)和l mol CO2(g)通入1 L水中.可得pH=10的溶液,则该溶液中浓度最大的阴离子是 ;
②常温下,将0.01 mol·L- NaOH溶液和0.01 mol·L-(NH4)2SO4溶液等体积混合.所得溶液pH为10,那么该混合液中c(Na+)+c(NH4+)= mol·L一(填准确代数式.不能估算)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
某同学组装了如图所示的电化学装置,则下列说法正确的是

A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3-的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U形物称量,质量会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com