
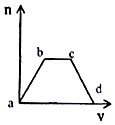
 将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:
将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:分析 向KOH和Ca(OH)2的混合稀溶液中通入CO2,氢氧化钙优先反应(ab段),反应的方程式为CO2+Ca(OH)2=CaCO3↓+H2O;然后KOH与二氧化碳反应(bc段):2KOH+CO2═K2CO3、K2CO3+H2O+CO2═2KHCO3;最后碳酸钙沉淀溶解(cd):CaCO3+H2O+CO2═Ca(HCO3)2,据此书写反应的离子方程式.
解答 解:(1)ab段氢氧化钙优先与二氧化碳反应生成碳酸钙沉淀和水,反应的离子方程式为:CO2+2OH-+Ca2+=CaCO3↓+H2O,
故答案为:CO2+2OH-+Ca2+=CaCO3↓+H2O;
(2)bc段KOH与二氧化碳反应生成碳酸钾,碳酸钾与二氧化碳反应生成碳酸氢钾,反应的离子方程式为:CO2+2OH-=CO32-+H2O、CO2+CO32-+H2O=2HCO3-,
故答案为:CO2+2OH-=CO32-+H2O;CO2+CO32-+H2O=2HCO3-;
(3)cd段沉淀逐渐减少,说明碳酸钙与二氧化碳反应生成碳酸氢钙,反应的离子方程式为:CO2+H2O+CaCO3=Ca2++2HCO3-,
故答案为:CO2+H2O+CaCO3=Ca2++2HCO3-.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应的先后顺序为解答关键,注意掌握离子方程式的书写原则是,试题培养了学生的分析能力及灵活应用能力.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳在高温下和二氧化碳的反应 | B. | 碳不完全燃烧 | ||
| C. | 氯化铵与氢氧化钡晶体的反应 | D. | 铝和氧化铁在高温下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③④⑤ | C. | ①②③④ | D. | ①②①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Mg2+、Cl-、SO42- | B. | Cu2+、Cl-、NO3-、OH- | ||
| C. | Ca2+、Na+、CO32-、NO3- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔 | B. | 聚乙烯 | C. | 聚苯乙烯 | D. | 聚丁二烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com