
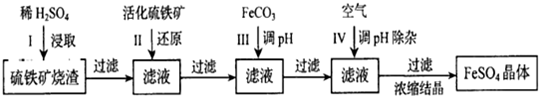
分析 硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水;
(2)用KSCN 溶液检验第Ⅱ步中Fe3+是否完全还原;
(3)氧气可以讲亚铁离子氧化为铁离子,铁离子水解使溶液pH降低;
(4)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,构造目标热化学方程式;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-;
(6)第Ⅲ步应加入FeCO3后,浸取时加入的硫酸、活化硫铁矿还原Fe3+时生成的硫酸完全转化为FeSO4,根据FeS2~7Fe2(S04)3~7Fe2O3计算参加反应的FeS2的物质的量,根据硫元素守恒计算n总(FeSO4),由Fe元素守恒计算n(FeCO3),再根据m=nM计算其质量.
解答 解:硫铁矿烧渣用硫酸浸取,过滤后滤液中含有硫酸铁、未反应的硫酸,用活化硫铁矿还原Fe3+后过滤,向滤液中加入FeCO3调节溶液pH,过滤后在通入空气、调节溶液pH,除去溶液中杂质离子,过滤浓缩结晶得到FeSO4晶体.
(1)H2SO4与Fe2O3反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)KMnO4溶液、K3[Fe(CN)6]溶液可以检验有Fe2+生成,取第Ⅱ步反应中溶液少许与试管中,滴加KSCN 溶液,若溶液不变红色,说明Fe3+完全被还原,
故答案为:C;
(3)氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+,使溶液pH降低,
故答案为:氧气可以将Fe2+离子氧化为Fe3+离子,Fe3+离子水解生成H+;
(4)发生反应:4FeCO3+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4CO2,
已知:①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ/mol
②C(s)+O2(g)═CO2(g)△H=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=-1480kJ/mol
根据盖斯定律,①-③×2+②×④可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g),故△H=-1648kJ/mol-2×(-1480kJ/mol)+4×(-393kJ/mol)=-260kJ/mol,
故反应热化学方程式为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ/mol;
(5)电池放电时的总反应为:4Li+FeS2═Fe+2Li2S,正极发生还原反应,FeS2获得电子生成Fe、S2-,正极电极反应式为:FeS2+4e-=Fe+2S2-,
故答案为:FeS2+4e-=Fe+2S2-;
(6)Fe2O3含量为50%,ckg烧渣中,Fe2O3质量为50%×ckg,铁的浸取率为96%,侧参加反应的Fe2O3质量为50%×ckg×96%,其物质的量为(50%×c×103×96%)g÷160g/mol=3c mol,
akg质量分数为b%的硫酸中m(H2SO4)=b%×akg,其物质的量为(b%×a×103)g÷98g/mol=$\frac{10ab}{98}$mol,
第Ⅲ步应加入FeCO3后,浸取时加入的硫酸、活化硫铁矿还原Fe3+时生成的硫酸完全转化为FeSO4,
根据FeS2~7Fe2(S04)3~7Fe2O3,可知参加反应的FeS2的物质的量$\frac{1}{7}$×3c mol,
根据硫元素守恒计算n总(FeSO4)=$\frac{1}{7}$×3c mol×2+$\frac{10ab}{98}$mol,
由Fe元素守恒n(FeCO3)=n总(FeSO4)-n(FeS2)-2n(Fe2O3)=$\frac{1}{7}$×3c mol×2+$\frac{10ab}{98}$mol-$\frac{1}{7}$×3c mol-2×3c mol=$\frac{10ab}{98}$mol-$\frac{39c}{7}$mol,故m(FeCO3)=($\frac{10ab}{98}$-$\frac{39c}{7}$)mol×116g/mol≈(11.8ab-646c)g,即为(0.0118ab-0.646c)Kg,
故答案为:(0.0118ab-0.646c).
点评 本题以化学工艺流程为载体,考查离子方程式书写、离子检验、热化学方程式书写、电极反应式、化学计算等,需要学生熟练掌握元素化合物知识,(6)中计算为易错点、难点,注意利用守恒法计算,避免计算繁琐,较好的考查学生分析计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 试管 | B. | 胶头滴管 | C. | 玻璃棒 | D. | 漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl、NaBr、KI三种无色溶液 | |
| B. | HCl、CaCl2、NaNO3、Na2CO3四种溶液 | |
| C. | NaBr、HCl、KCl三种溶液 | |
| D. | 氯化钠、淀粉碘化钾、溴化钾、溴水四种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO${\;}_{3}^{-}$+OH-═CaCO3↓+H2O | |
| B. | 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| C. | 1L2mol•L-1的FeBr2溶液中通入2.5mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 | |
| D. | 以石墨作电极电解CuCl2溶液:2Cl-+2H2O═2OH-+Cl2↑十H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质“溶液”是一种胶体,向该分散系中加入少量的盐(如硫酸铵)能促进蛋白质的溶解 | |
| B. | 饱和(NH4)2SO4溶液能使蛋白质变性 | |
| C. | 用半透膜可除去蛋白质溶液中的NaCl | |
| D. | 用灼烧的方法检验是毛线还是棉线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75%的酒精用于消毒 | B. | Al(OH)3可用于治疗胃酸过多 | ||
| C. | 明矾用于水的杀菌消毒 | D. | 从海底提取可燃冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁与足量的氢氧化钠溶液反应:Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 氧化铝和过量的烧碱溶液反应:Al2O3+3OH-═2AlO2-+H2O | |
| C. | 氯化铝溶液与少量NaOH溶液反应:Al3++3OH-═Al(OH)3↓ | |
| D. | 向碳酸钙中滴加醋酸溶液:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏低 | |
| B. | 用托盘天平称取25.20 g NaCl | |
| C. | 用100 mL的量筒量取5.2 mL的盐酸 | |
| D. | 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线读数会导致所配溶液浓度偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com