
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3的反应方程式___________________________________________。
(2)已知:Se+2H2SO4(浓)―→2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O―→Se+2SO42—+4H+,则SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:①SeO2+KI+HNO3―→Se+I2+KNO3+H2O
②I2+2Na2S2O3―→Na2S4O6+2NaI。配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为________。
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:填空题
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式 。
(2)整个过程中的还原剂是 。
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为20~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)等物质的量的下列化合物与足量浓盐酸反应,得到氯气的物质的量最多的是
________(填序号)。
已知:MnO4-+H++Cl-―→Mn2++Cl2↑+H2O(未配平)
ClO3-+H++Cl-―→Cl2↑+H2O(未配平)
ClO-+H++Cl-―→Cl2↑+H2O(未配平)
A.KClO3 B.KMnO4 C.MnO2 D.Ca(ClO)2
(2)已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是________(填序号)。
A.3Cl2+6FeI2=2FeCl3+4FeI3
B.Cl2+FeI2=FeCl2+I2
C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
D.2Fe3++2I-=2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电镀厂镀铜废水中含有CN-和Cr2O72-,需要处理达标后才能排放。该厂拟定下列流程进行废水处理:
回答下列问题:
(1)上述处理废水流程中主要使用的方法是________。
(2)②中反应后无气体放出,该反应的离子方程式为______________________________
__________________________________。
(3)步骤③中,每处理0.4 mol Cr2O72-时转移电子2.4 mol,该反应的离子方程式为________________________________________________________________________。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:
________________________________________________________________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O,将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol Cr2O72-,需加入a mol FeSO4·7H2O,下列结论正确的是________。
| A.x=0.5,a=8 | B.x=0.5,a=10 |
| C.x=1.5,a=8 | D.x=1.5,a=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
(1)在定向爆破中,常利用氧化铁与铝反应放出的热量来切割钢筋,该反应的化学方程式为__。
(2)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) △H=+468.2 kJ·mol-1
C(s)+O2(g)=CO2(g) △H="-393.5" kJ·mol-1。
则Fe(s)与O2 (g)反应生成Fe2 O3 (s)的热化学方程式为______________________。
(3)可用KMnO4溶液滴定Fe2+的浓度,反应的离子方程式如下:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①KMnO4溶液应盛放在_____滴定管中;
②判断达到滴定终点的现象是_____;
③用硫酸酸化的0.020 00 mol·L-1。KMnO4溶液滴定某FeSO4溶液至终点,实验数据记录如下表: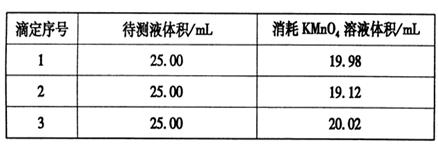
请分析数据并计算,该FeSO4溶液的物质的量浓度为_____。
(4)新型纳米材料ZnFe2Ox,可用于除去工业废气中的某些氧化物。制取新材料和除去废气的转化关系如下图: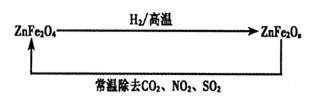
①已知ZnFe2O4与H2反应的物质的量之比为2:1,则ZnFe2Ox中x=_____;
②用ZnFe2Ox除去SO2的过程中,氧化剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
________KBrO3+________+________H2SO4―→……;
③若转移10 mol电子,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com