
| A. | 1 mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 1 L 1mol/L的盐酸含有NA个HCl分子 | |
| C. | 标准状况下,33.6 L四氯化碳中含有氯原子的数目为6NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA |
分析 A、亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气;
B、HCl为强电解质,在溶液中电离;
C、标况下,四氯化碳为液态;
D、此反应中生成的2molHNO3完全来自于NO3-,NH4+和NO3-发生归中反应.
解答 解:A、1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故A错误;
B、HCl为强电解质,在溶液中电离,不存在HCl分子,故B错误;
C、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算,故C错误;
D、此反应中生成的2molHNO3完全来自于NO3-,5molNH4+和3molNO3-发生归中反应生成4mol氮气,故转移15mol电子时生成4mol氮气,即生成28 g N2时即1mol,转移的电子数目为3.75NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
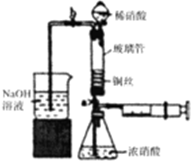 利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:
利用下列装置可实现铜与浓硝酸、稀硝酸反应,过程如下:| 实验编号 | 水温/℃ | 液面上升高度 |
| 1 | 25 | $\frac{2}{3}$ |
| 2 | 50 | 不足试管的$\frac{2}{3}$ |
| 3 | 0 | 液面上升超过实验1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
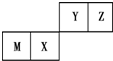
| A. | 原子半径Z<M | |
| B. | Y的最高价氧化物对应水化物的酸性比X的弱 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | Z位于元素周期表中第2周期第ⅥA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol•L-1NaOH溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:A13+、Na+、NO3-、C1- | |
| C. | 在0.1 mol•L-1FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在$\frac{{c(H}^{+})}{{c(OH}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
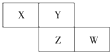 X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )
X、Y、Z均为短周期元素,X的单质在空气中含量最高,它们在周期表中位置如图,则下列说法不正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的弱 | |
| D. | X与Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 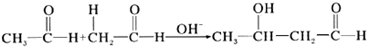 | |
| B. | CH2=CH-CH=CH2+2H2$→_{△}^{催化剂}$CH3-CH2-CH-CH3 | |
| C. | 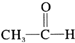 +H2$→_{△}^{催化剂}$CH3-CH-OH +H2$→_{△}^{催化剂}$CH3-CH-OH | |
| D. | CH3-CH2Br+NaOH$→_{△}^{H_{2}O}$CH3-CH2OH+NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
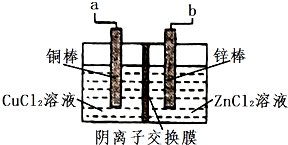 一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如图,如表选项两栏内容正确且相关联的是( )| 选项 | 操作与现象 | 解释与推论 |
| A | 电池放电时化学能转化为电能 | Zn(s)+Cu2+(aq)=Zn2++Cu(s)△H>0 |
| B | 该电池充电时铜棒变细 | 两电极区溶液颜色都变深 |
| C | 该电池放电时铜棒是电池正极 | Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D | 该电池充电时a接电源正极 | 电极反应Cu2++2e-=Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于胶体,可发生丁达尔效应 | |
| B. | 所得的分散系中,分散质的主要成分为FeO | |
| C. | 该分散系进行电泳实验时,阳极周围黑色加深 | |
| D. | 往油酸钠水溶液中滴加浓溴水振荡,无明显现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com