
【题目】碳酸钠、碳酸氢钠是日常生产生活中常用的两种盐。在实验室中制取NaHCO3的方法有多种。请
依据下列方法回答问题:
方法一:模拟工业“侯氏制碱法”制取:(原理NaCl+H2O+CO2+NH3 = NaHCO3↓+NH4Cl)
第一步:连接好装置,检验气密性,在仪器内装人药品。
第二步:让某一装置先发生反应,直到产生的气体不能再在Ⅲ中溶解,再通入另一装置中产生的气体,片刻后,Ⅲ中出现固体。继续向Ⅲ中通入两种气体,直到不再有固体产生。
第三步:分离Ⅲ中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。

(1)图中所示装置的连接顺序是:a接f;e接________;b接_________(填接口编号)。
(2)I中盛放稀盐酸的仪器名称是_____________,IV中应选用的液体为________________。
(3)第二步中让_____________ (填序号)装置先发生反应。
(4)第四步中所加固体粉末为________。所得的晶体中常含有少置的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,不使用其他任何试剂,证明所得晶体大部分是NH4Cl。简要写出操作和现象______________________。
方法二:把CO2通人饱和Na2CO3溶液制取NaHCO3。装置如下图所示(气密性已检验,部分夹持装置略):

(5)请结合化学平衡移动原理解释B中溶液的作用_________________。
(6)当C中有大量白色固体析出时,停止实验,将固体过滤、洗涤、干燥备用。为确定固体的成分,实验小组设计方案如下(取一定量的固体,配成溶液作为样液,其余固体备用):
①方案1:取样液与澄清的Ca(OH)2溶液混合,出现白色沉淀。
实验小组对现象产生的原理进行分析,认为该方案不合理,理由是________________。
②方案2:取样液与BaCl2溶液混合,出现白色沉淀并有气体产生。
实验小组认为固体中存在NaHCO3,其离子方程式是________________。
【答案】 d c II 饱和碳酸氢钠溶液 NaCl 取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结。 CO2在水中存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO
HCO![]() +H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体。 Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。 2HCO
+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体。 Na2CO3和NaHCO3都能跟Ca(OH)2溶液发生反应生成白色沉淀,无法确定固体的成分中是否含有NaHCO3。 2HCO![]() +Ba2+ = BaCO3↓+ CO2↑+H2O NaOH + CO2=NaHCO3; Ca(HCO3)2+ NaOH== NaHCO3+ CaCO3 +H2O
+Ba2+ = BaCO3↓+ CO2↑+H2O NaOH + CO2=NaHCO3; Ca(HCO3)2+ NaOH== NaHCO3+ CaCO3 +H2O
其它合理方法均可。
【解析】本题考查实验设计方案的评价,(1)装置I是制备CO2,装置II制备氨气,因为氨气极易溶于水,为防止倒吸,因此b接c,制出的CO2中混有HCl,必须除去,因此a接f,e接d;(2)盛放稀盐酸的装置是长颈漏斗,除去CO2中的HCl,常通过饱和碳酸氢钠溶液,即装置IV中盛放饱和NaHCO3溶液;(3)因为CO2在水中的溶解度小,氨气极易溶于水,且水溶液显碱性,为充分利用CO2,减少浪费,因此先通NH3,让装置II先反应;(4)第四步中加固体NaCl,让NH4Cl晶体析出;具体操作是:取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结;(5)CO2在水中存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;(6)①Ca(OH)2与Na2CO3反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,碳酸氢钠与Ca(OH)2反应:Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,两个都会产生沉淀,因此Na2CO3对NaHCO3检验产生干扰;②沉淀是BaCO3,气体是CO2,因此有2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O。
HCO3-+H+,有H2SO4存在时,可使上述平衡向左移动,从而减少CO2在水中的溶解,同时吸收挥发出来的HCl气体;(6)①Ca(OH)2与Na2CO3反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,碳酸氢钠与Ca(OH)2反应:Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,两个都会产生沉淀,因此Na2CO3对NaHCO3检验产生干扰;②沉淀是BaCO3,气体是CO2,因此有2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )

A. a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
D. d点对应的溶液中:K+、NH4+、I﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸铁晶体Fe2(C2O4)3·xH2O通过相关处理后可溶于水,且能做净水剂,在110℃可完全失去结晶水。为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
步骤1:称量4.66g草酸铁晶体进行处理后,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根
恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol·L-1 KMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol·L-1) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V2 = 20.12 |
3 | 0.0200 | V3 = 19.98 |
请回答下列问题:
(1)草酸铁溶液能做净水剂的原因_________________(用离子方程式表示)
(2)该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,一定需用下列仪器中的______________ (填序号)
酸式滴定管 B.碱式滴定管 C.量筒(10 mL) D.锥形瓶
E.胶头滴管 F.漏斗 G.250 mL容量瓶
(3)加入锌粉的目的是______________________
(4)步骤3滴定时是否选择指示剂_________(是或否);说明理由_________________________写出步骤3中发生反应的离子方程式____________________________
(5)在步骤2中,若加入的KMnO4溶液的量不够,则测得的铁含量________(填“偏低”、“偏高”或“不变”);实验测得该晶体中结晶水的个数x为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL的某稀盐酸中滴入0.1 mol·L-1的氨水,溶液中由水电离出的氢离子浓度随滴人氨水体积的变化如图。下列分析不正确的是
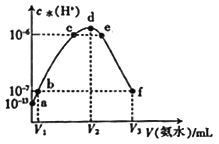
A. V2=20 mL
B. d点溶液中:c(NH4+)>c(Cl-)
C. b点溶液中:c(H+)=c(OH-)
D. 该稀盐酸的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
(1)写出基态E原子的价电子排布式 .
(2)B、C、D三元素第一电离能由小到大的顺序为(用元素符号表 示) ;A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与 BD化合物是等电子体,据等电子体的原理,写出BD化合物的电子式 ; A2D由液态形成晶体时密度 (填增大,不变或减小),分析主要原因(用文字叙述)
(3)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为(用元素符号表示) ;若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3(用含a、NA的符号表示).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+XD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+XD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为______________mol/L·
(2)前5min内用B表示的化学反应速率v(B)为_________mol/(L·min)。
(3)化学方程式中X值为__________ 。
(4)此反应在四种不同情况下的反应速率分别为:①v(A)=5mol/(L·min);②v(B)=6mol/(L·min);③v(C)=4.5mol/(L·min);④v(D)=8mol/(L·min)。
其中反应速率最快的是__________(填编号)。
Ⅱ、(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为_________。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48 L,通入足量的溴水,溴水质量增加2.8 g,此两种烃的组成为______________(填分子式)。
(3) 有机物的结构可用“键线式”表示,如:![]() 可简写为
可简写为![]()
![]() 可简写为
可简写为 ![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图, ,苧烯的分子式为___________。
,苧烯的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. CS2为V形的极性分子,形成分子晶体
B. ClO3-的空间构型为平面三角形
C. NCl3的N-Cl键长大于NH3的N-H键长,由此可推知NCl3的沸点低于NH3
D. SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 一般而言,n越大,电子离核平均距离越远,能量越低
B. 确定的n值,l有2n+1个值
C. 确定的l值,原子轨道数为2l个
D. ms描述电子自旋状态,电子的自旋状态与n、l无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com